- Пластиды
- Цитоскелет
- Органоиды движения
- «Как белка в колесе» — динамика митохондрий
- Здоровые циклы деления и слияния – залог метаболического здоровья клетки
- Митофузины – не просто какие-то белки
- Гипоталамус, митохондрии, метаболическая дисфункция и старение
- Так кто и как регулирует чувствительность нейронов гипоталамуса?
- Как повлиять на динамику митохондрий?
- Генная терапия митохондрий
- Перенос митохондрий
- Лекция № 7. Эукариотическая клетка
- Рибосомы
- Клеточный центр
- Эндоплазматическая сеть
- Вакуоли
- Аппарат Гольджи
- Лизосомы
Пластиды

Строение пластид: 1 — наружная мембрана; 2 — внутренняя мембрана; 3 — строма; 4 — тилакоид; 5 — грана; 6 — ламеллы; 7 — зерна крахмала; 8 — липидные капли.
Пластиды характерны только для растительных клеток. Различают три основных типа пластид: лейкопласты — бесцветные пластиды в клетках неокрашенных частей растений, хромопласты — окрашенные пластиды обычно желтого, красного и оранжевого цветов, хлоропласты — зеленые пластиды.
Хлоропласты. В клетках высших растений хлоропласты имеют форму двояковыпуклой линзы. Длина хлоропластов колеблется в пределах от 5 до 10 мкм, диаметр — от 2 до 4 мкм. Хлоропласты ограничены двумя мембранами. Наружная мембрана (1) гладкая, внутренняя (2) имеет сложную складчатую структуру. Наименьшая складка называется тилакоидом (4). Группа тилакоидов, уложенных наподобие стопки монет, называется граной (5). В хлоропласте содержится в среднем 40–60 гран, расположенных в шахматном порядке. Граны связываются друг с другом уплощенными каналами — ламеллами (6). В мембраны тилакоидов встроены фотосинтетические пигменты и ферменты, обеспечивающие синтез АТФ. Главным фотосинтетическим пигментом является хлорофилл, который и обусловливает зеленый цвет хлоропластов.
Внутреннее пространство хлоропластов заполнено стромой (3). В строме имеются кольцевая «голая» ДНК, рибосомы 70S-типа, ферменты цикла Кальвина, зерна крахмала (7). Внутри каждого тилакоида находится протонный резервуар, происходит накопление Н+. Хлоропласты, также как митохондрии, способны к автономному размножению путем деления надвое. Они содержатся в клетках зеленых частей высших растений, особенно много хлоропластов в листьях и зеленых плодах. Хлоропласты низших растений называют хроматофорами.
Функция хлоропластов: фотосинтез. Полагают, что хлоропласты произошли от древних эндосимбиотических цианобактерий (теория симбиогенеза). Основанием для такого предположения является сходство хлоропластов и современных бактерий по ряду признаков (кольцевая, «голая» ДНК, рибосомы 70S-типа, способ размножения).
Лейкопласты. Форма варьирует (шаровидные, округлые, чашевидные и др.). Лейкопласты ограничены двумя мембранами. Наружная мембрана гладкая, внутренняя образует малочисленные тилакоиды. В строме имеются кольцевая «голая» ДНК, рибосомы 70S-типа, ферменты синтеза и гидролиза запасных питательных веществ. Пигменты отсутствуют. Особенно много лейкопластов имеют клетки подземных органов растения (корни, клубни, корневища и др.). Функция лейкопластов: синтез, накопление и хранение запасных питательных веществ. Амилопласты — лейкопласты, которые синтезируют и накапливают крахмал, элайопласты — масла, протеинопласты — белки. В одном и том же лейкопласте могут накапливаться разные вещества.
Хромопласты. Ограничены двумя мембранами. Наружная мембрана гладкая, внутренняя или также гладкая, или образует единичные тилакоиды. В строме имеются кольцевая ДНК и пигменты — каротиноиды, придающие хромопластам желтую, красную или оранжевую окраску. Форма накопления пигментов различная: в виде кристаллов, растворены в липидных каплях (8) и др. Содержатся в клетках зрелых плодов, лепестков, осенних листьев, редко — корнеплодов. Хромопласты считаются конечной стадией развития пластид.
Функция хромопластов: окрашивание цветов и плодов и тем самым привлечение опылителей и распространителей семян.
Все виды пластид могут образовываться из пропластид. Пропластиды — мелкие органоиды, содержащиеся в меристематических тканях. Поскольку пластиды имеют общее происхождение, между ними возможны взаимопревращения. Лейкопласты могут превращаться в хлоропласты (позеленение клубней картофеля на свету), хлоропласты — в хромопласты (пожелтение листьев и покраснение плодов). Превращение хромопластов в лейкопласты или хлоропласты считается невозможным.
Цитоскелет
Цитоскелет образован микротрубочками и микрофиламентами. Микротрубочки — цилиндрические неразветвленные структуры. Длина микротрубочек колеблется от 100 мкм до 1 мм, диаметр составляет примерно 24 нм, толщина стенки — 5 нм. Основной химический компонент — белок тубулин. Микротрубочки разрушаются под воздействием колхицина. Микрофиламенты — нити диаметром 5–7 нм, состоят из белка актина. Микротрубочки и микрофиламенты образуют в цитоплазме сложные переплетения. Функции цитоскелета: 1) определение формы клетки, 2) опора для органоидов, 3) образование веретена деления, 4) участие в движениях клетки, 5) организация тока цитоплазмы.
Органоиды движения
Присутствуют не во всех клетках. К органоидам движения относятся реснички (инфузории, эпителий дыхательных путей), жгутики (жгутиконосцы, сперматозоиды), ложноножки (корненожки, лейкоциты), миофибриллы (мышечные клетки) и др.
Жгутики и реснички — органоиды нитевидной формы, представляют собой аксонему, ограниченную мембраной. Аксонема — цилиндрическая структура; стенка цилиндра образована девятью парами микротрубочек, в его центре находятся две одиночные микротрубочки. В основании аксонемы находятся базальные тельца, представленные двумя взаимно перпендикулярными центриолями (каждое базальное тельце состоит из девяти триплетов микротрубочек, в его центре микротрубочек нет). Длина жгутика достигает 150 мкм, реснички в несколько раз короче.
Миофибриллы состоят из актиновых и миозиновых миофиламентов, обеспечивающих сокращение мышечных клеток.
Время на прочтение
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
«Как белка в колесе» — динамика митохондрий
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
Так кто и как регулирует чувствительность нейронов гипоталамуса?
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Перенос митохондрий
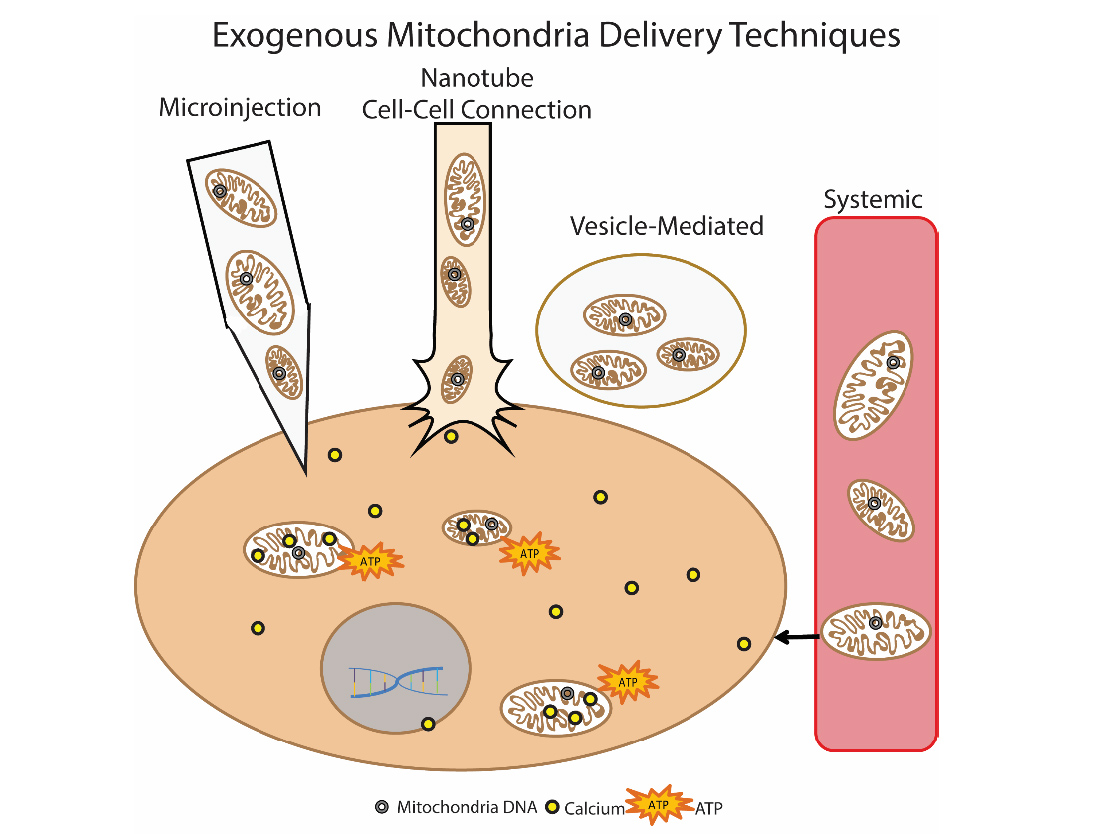
Рис.9 Способы доставки экзогенных митохондрий в клетку
Автор Ольга Борисова
1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S1550413116305022
2. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig1
3. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig3
4. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S0005272816300858
5. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full
6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs2
7. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S1550413116301176
8. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-6
9. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S0962892417301587
10. raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.10398
11. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-9
14. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223(17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053
Лекция № 7. Эукариотическая клетка
Органоиды — постоянные, обязательно присутствующие, компоненты клетки, выполняющие специфические функции.
Рибосомы

Строение рибосомы:1 — большая субъединица; 2 — малая субъединица.
Рибосомы — немембранные органоиды, диаметр примерно 20 нм. Рибосомы состоят из двух субъединиц — большой и малой, на которые могут диссоциировать. Химический состав рибосом — белки и рРНК. Молекулы рРНК составляют 50–63% массы рибосомы и образуют ее структурный каркас. Различают два типа рибосом: 1) эукариотические (с константами седиментации целой рибосомы — 80S, малой субъединицы — 40S, большой — 60S) и 2) прокариотические (соответственно 70S, 30S, 50S).
В составе рибосом эукариотического типа 4 молекулы рРНК и около 100 молекул белка, прокариотического типа — 3 молекулы рРНК и около 55 молекул белка. Во время биосинтеза белка рибосомы могут «работать» поодиночке или объединяться в комплексы — полирибосомы (полисомы). В таких комплексах они связаны друг с другом одной молекулой иРНК. Прокариотические клетки имеют рибосомы только 70S-типа. Эукариотические клетки имеют рибосомы как 80S-типа (шероховатые мембраны ЭПС, цитоплазма), так и 70S-типа (митохондрии, хлоропласты).
Субъединицы рибосомы эукариот образуются в ядрышке. Объединение субъединиц в целую рибосому происходит в цитоплазме, как правило, во время биосинтеза белка.
Функция рибосом: сборка полипептидной цепочки (синтез белка).
Клеточный центр
Клеточный центр включает в себя две центриоли и центросферу. Центриоль представляет собой цилиндр, стенка которого образована девятью группами из трех слившихся микротрубочек (9 триплетов), соединенных между собой через определенные интервалы поперечными сшивками. Центриоли объединены в пары, где они расположены под прямым углом друг к другу. Перед делением клетки центриоли расходятся к противоположным полюсам, и возле каждой из них возникает дочерняя центриоль. Они формируют веретено деления, способствующее равномерному распределению генетического материала между дочерними клетками. В клетках высших растений (голосеменные, покрытосеменные) клеточный центр центриолей не имеет. Центриоли относятся к самовоспроизводящимся органоидам цитоплазмы, они возникают в результате дупликации уже имеющихся центриолей. Функции: 1) обеспечение расхождения хромосом к полюсам клетки во время митоза или мейоза, 2) центр организации цитоскелета.
Эндоплазматическая сеть
Эндоплазматическая сеть (ЭПС), или эндоплазматический ретикулум (ЭПР), — одномембранный органоид. Представляет собой систему мембран, формирующих «цистерны» и каналы, соединенных друг с другом и ограничивающих единое внутреннее пространство — полости ЭПС. Мембраны с одной стороны связаны с цитоплазматической мембраной, с другой — с наружной ядерной мембраной. Различают два вида ЭПС: 1) шероховатая (гранулярная), содержащая на своей поверхности рибосомы, и 2) гладкая (агранулярная), мембраны которой рибосом не несут.
Функции: 1) транспорт веществ из одной части клетки в другую, 2) разделение цитоплазмы клетки на компартменты ( «отсеки»), 3) синтез углеводов и липидов (гладкая ЭПС), 4) синтез белка (шероховатая ЭПС), 5) место образования аппарата Гольджи.
Вакуоли
Вакуоли — одномембранные органоиды, представляют собой «емкости», заполненные водными растворами органических и неорганических веществ. В образовании вакуолей принимают участие ЭПС и аппарат Гольджи. Молодые растительные клетки содержат много мелких вакуолей, которые затем по мере роста и дифференцировки клетки сливаются друг с другом и образуют одну большую центральную вакуоль. Центральная вакуоль может занимать до 95% объема зрелой клетки, ядро и органоиды оттесняются при этом к клеточной оболочке. Мембрана, ограничивающая растительную вакуоль, называется тонопластом. Жидкость, заполняющая растительную вакуоль, называется клеточным соком. В состав клеточного сока входят водорастворимые органические и неорганические соли, моносахариды, дисахариды, аминокислоты, конечные или токсические продукты обмена веществ (гликозиды, алкалоиды), некоторые пигменты (антоцианы).
В животных клетках имеются мелкие пищеварительные и автофагические вакуоли, относящиеся к группе вторичных лизосом и содержащие гидролитические ферменты. У одноклеточных животных есть еще сократительные вакуоли, выполняющие функцию осморегуляции и выделения.
Функции вакуоли: 1) накопление и хранение воды, 2) регуляция водно-солевого обмена, 3) поддержание тургорного давления, 4) накопление водорастворимых метаболитов, запасных питательных веществ, 5) окрашивание цветов и плодов и привлечение тем самым опылителей и распространителей семян, 6) см. функции лизосом.
Эндоплазматическая сеть, аппарат Гольджи, лизосомы и вакуоли образуют единую вакуолярную сеть клетки, отдельные элементы которой могут переходить друг в друга.
Аппарат Гольджи
Аппарат Гольджи, или комплекс Гольджи, — одномембранный органоид. Представляет собой стопки уплощенных «цистерн» с расширенными краями. С ними связана система мелких одномембранных пузырьков (пузырьки Гольджи). Каждая стопка обычно состоит из 4-х–6-ти «цистерн», является структурно-функциональной единицей аппарата Гольджи и называется диктиосомой. Число диктиосом в клетке колеблется от одной до нескольких сотен. В растительных клетках диктиосомы обособлены.
Аппарат Гольджи обычно расположен около клеточного ядра (в животных клетках часто вблизи клеточного центра).
Функции аппарата Гольджи: 1) накопление белков, липидов, углеводов, 2) модификация поступивших органических веществ, 3) «упаковка» в мембранные пузырьки белков, липидов, углеводов, 4) секреция белков, липидов, углеводов, 5) синтез углеводов и липидов, 6) место образования лизосом. Секреторная функция является важнейшей, поэтому аппарат Гольджи хорошо развит в секреторных клетках.
Лизосомы
Лизосомы — одномембранные органоиды. Представляют собой мелкие пузырьки (диаметр от 0,2 до 0,8 мкм), содержащие набор гидролитических ферментов. Ферменты синтезируются на шероховатой ЭПС, перемещаются в аппарат Гольджи, где происходит их модификация и упаковка в мембранные пузырьки, которые после отделения от аппарата Гольджи становятся собственно лизосомами. Лизосома может содержать от 20 до 60 различных видов гидролитических ферментов. Расщепление веществ с помощью ферментов называют лизисом.
Различают: 1) первичные лизосомы, 2) вторичные лизосомы. Первичными называются лизосомы, отшнуровавшиеся от аппарата Гольджи. Первичные лизосомы являются фактором, обеспечивающим экзоцитоз ферментов из клетки.
Вторичными называются лизосомы, образовавшиеся в результате слияния первичных лизосом с эндоцитозными вакуолями. В этом случае в них происходит переваривание веществ, поступивших в клетку путем фагоцитоза или пиноцитоза, поэтому их можно назвать пищеварительными вакуолями.
Автофагия — процесс уничтожения ненужных клетке структур. Сначала подлежащая уничтожению структура окружается одинарной мембраной, затем образовавшаяся мембранная капсула сливается с первичной лизосомой, в результате также образуется вторичная лизосома (автофагическая вакуоль), в которой эта структура переваривается. Продукты переваривания усваиваются цитоплазмой клетки, но часть материала так и остается непереваренной. Вторичная лизосома, содержащая этот непереваренный материал, называется остаточным тельцем. Путем экзоцитоза непереваренные частицы удаляются из клетки.
Автолиз — саморазрушение клетки, наступающее вследствие высвобождения содержимого лизосом. В норме автолиз имеет место при метаморфозах (исчезновение хвоста у головастика лягушек), инволюции матки после родов, в очагах омертвления тканей.
Функции лизосом: 1) внутриклеточное переваривание органических веществ, 2) уничтожение ненужных клеточных и неклеточных структур, 3) участие в процессах реорганизации клеток.

Строение митохондрии: 1 — наружная мембрана;2 — внутренняя мембрана; 3 — матрикс; 4 — криста; 5 — мультиферментная система; 6 — кольцевая ДНК.
Форма, размеры и количество митохондрий чрезвычайно варьируют. По форме митохондрии могут быть палочковидными, округлыми, спиральными, чашевидными, разветвленными. Длина митохондрий колеблется в пределах от 1,5 до 10 мкм, диаметр — от 0,25 до 1,00 мкм. Количество митохондрий в клетке может достигать нескольких тысяч и зависит от метаболической активности клетки.
Митохондрия ограничена двумя мембранами. Наружная мембрана митохондрий (1) гладкая, внутренняя (2) образует многочисленные складки — кристы (4). Кристы увеличивают площадь поверхности внутренней мембраны, на которой размещаются мультиферментные системы (5), участвующие в процессах синтеза молекул АТФ. Внутреннее пространство митохондрий заполнено матриксом (3). В матриксе содержатся кольцевая ДНК (6), специфические иРНК, рибосомы прокариотического типа (70S-типа), ферменты цикла Кребса.
Митохондриальная ДНК не связана с белками («голая»), прикреплена к внутренней мембране митохондрии и несет информацию о строении примерно 30 белков. Для построения митохондрии требуется гораздо больше белков, поэтому информация о большинстве митохондриальных белков содержится в ядерной ДНК, и эти белки синтезируются в цитоплазме клетки. Митохондрии способны автономно размножаться путем деления надвое. Между наружной и внутренней мембранами находится протонный резервуар, где происходит накопление Н+.
Функции митохондрий: 1) синтез АТФ, 2) кислородное расщепление органических веществ.
Согласно одной из гипотез (теория симбиогенеза) митохондрии произошли от древних свободноживущих аэробных прокариотических организмов, которые, случайно проникнув в клетку-хозяина, затем образовали с ней взаимовыгодный симбиотический комплекс. В пользу этой гипотезы свидетельствуют следующие данные. Во-первых, митохондриальная ДНК имеет такие же особенности строения как и ДНК современных бактерий (замкнута в кольцо, не связана с белками). Во-вторых, митохондриальные рибосомы и рибосомы бактерий относятся к одному типу — 70S-типу. В-третьих, механизм деления митохондрий сходен с таковым бактерий. В-четвертых, синтез митохондриальных и бактериальных белков подавляется одинаковыми антибиотиками.








