- Функции митохондрий и энергообразование
- Конкурс «Био/Мол/Текст»-2021/2022
- Скачать комикс в pdf
- Митохондрии в клетке
- Вода и еда?
- Внешние ссылки
- Объем или интенсивность?
- Каким образом митохондрии вырабатывают энергию?
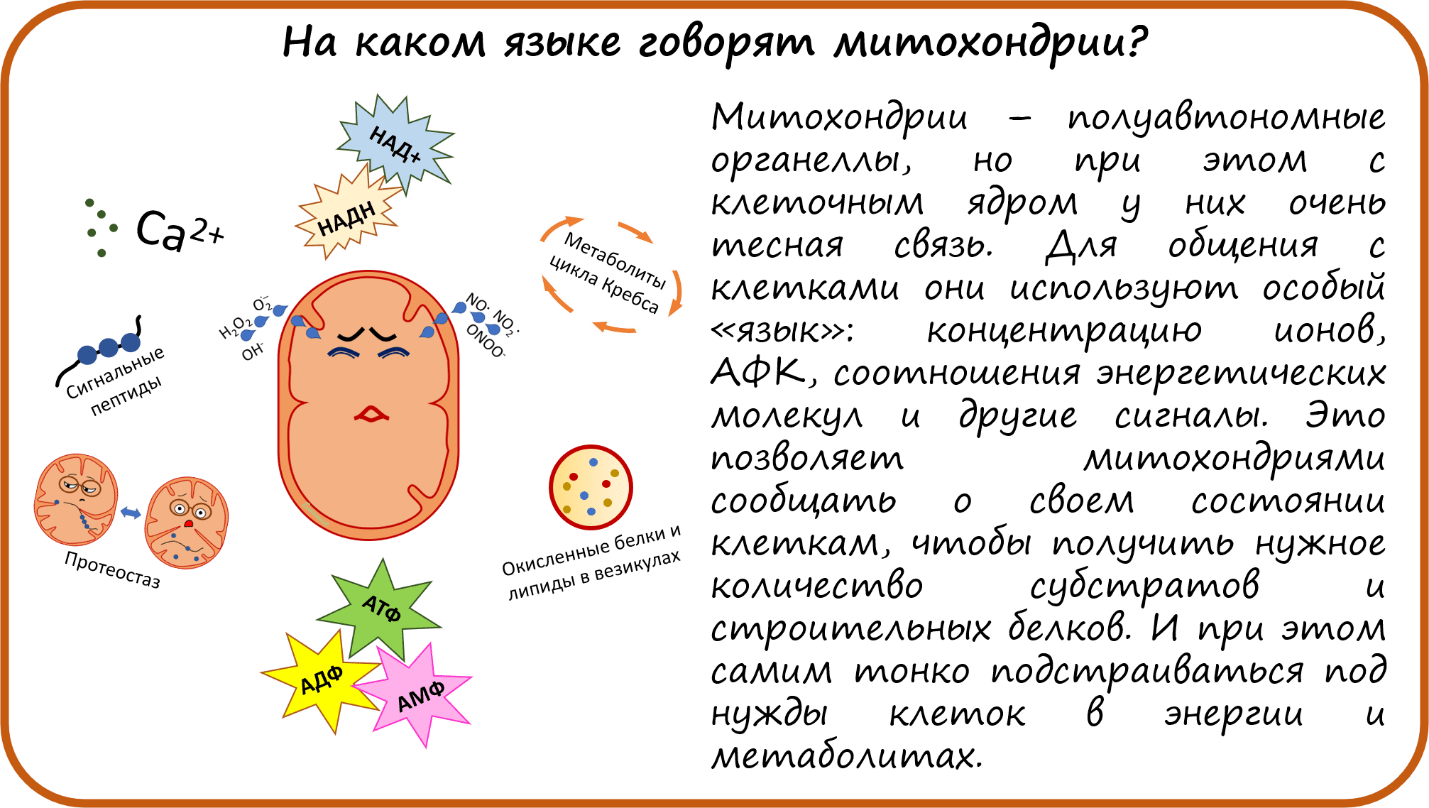
- На каком языке говорят митохондрии?
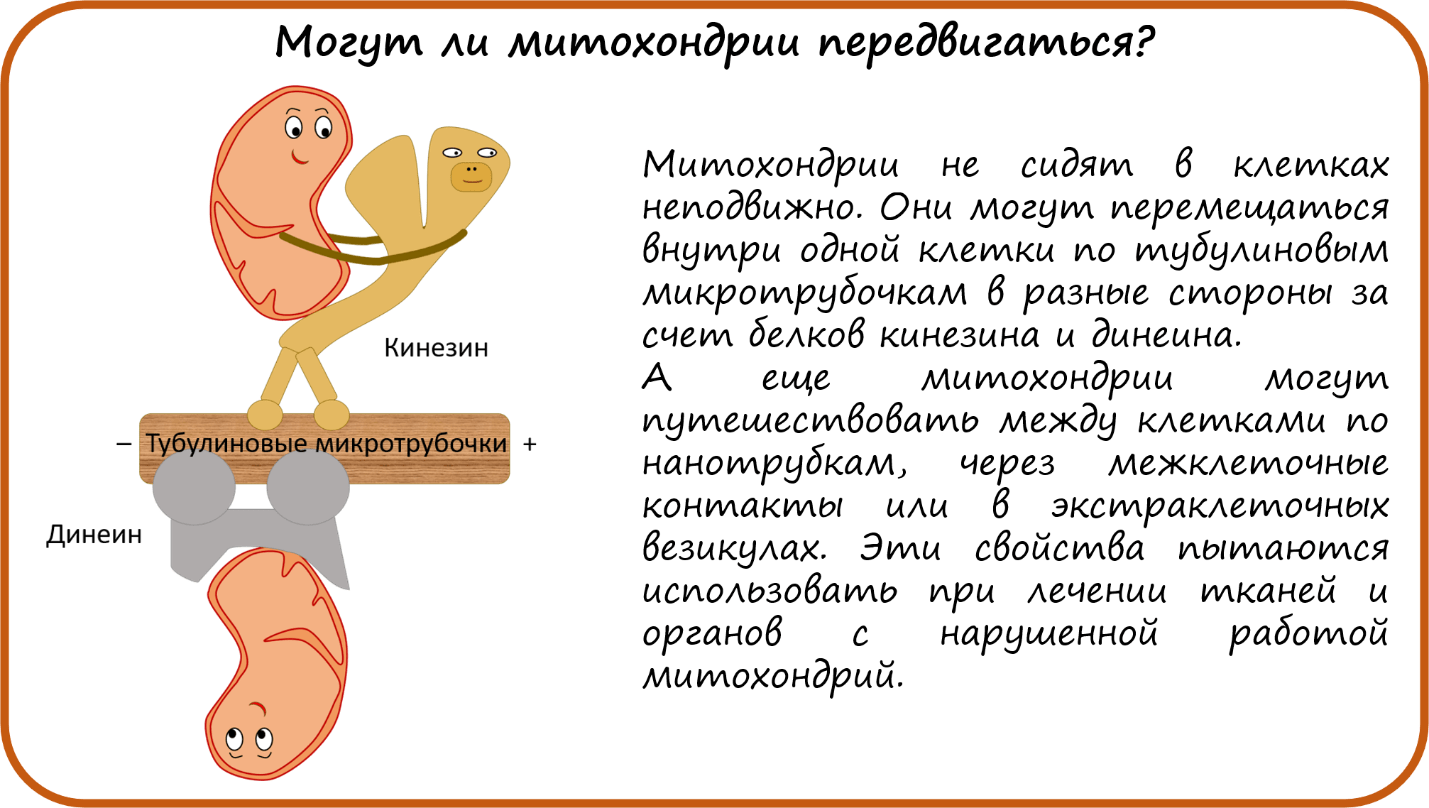
- Могут ли митохондрии передвигаться?
- Популяционные генетические исследования
- Как митохондрии управляют судьбой клетки?
- Структура
- Наружная мембрана
- Межмембранное пространство
- Внутренняя мембрана
- Cristae
- Матрица
- Перенос фосфолипидов
- Передача сигналов кальция
- Молекный основа для привязки
- Перспектива
- Долгожданный спектр ГКР митохондрий
Функции митохондрий и энергообразование
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
- Перенос электронов с НАДН на кислород по дыхательной цепи;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
- Большой олигомерный фермент, катализирующий перенос электронов;
- Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
- Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Скачать комикс в pdf
Митохондрии в клетке
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1-2 тысяч и занимающие 10-20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5-1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышенную электронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.
Вода и еда?
Оптимальная функция клеток и внутриклеточных структур невозможна без поддержания оптимального водно-электролитного баланса, а также регулярного поступления питательных веществ, в частности углеводов. Внимательно следите за тем, чтобы пить достаточное количество воды, а также соблюдайте сбалансированную диету, чтобы обеспечить организм необходимыми строительными материалами.
Внешние ссылки
- Mitodb.com – База данных митохондриальных заболеваний.
- Атлас митохондрий в Университете Майнца
- Портал исследования митохондрий на mitochondrial.net
- Митохондрии: архитектура определяет функцию на cytochemistry.net
- Митохондрии ссылки в Университете из Алабамы
- MIP Общество физиологии митохондрий
- 3D-структуры белков внутренней митохондриальной мембраны в Мичиганский университет
- 3D-структуры белков, связанных с внешней митохондриальной мембраной в Мичиганский университет
- Партнерство митохондриальных белков в Висконсинском университете
- MitoMiner – база данных митохондриальной протеомики в MRC Mitochondrial Biology Unit
- Mitochondrion – Cell Centered Database
- Митохондрии, реконструированные с помощью электронной томографии в Государственном университете Сан-Диего
- Видеоклип с митохондриями из печени крысы n из Криоэлектронной томографии
Объем или интенсивность?
Как стало понятно, регулярные тренировки — наилучший способ повлиять на митохондрии. Но что выбрать — объем или интенсивность? Правильный ответ — и то и другое. Давайте разберемся, как влияют на митохондрии повышение тренировочного объема и увеличение интенсивности.
Каким образом митохондрии вырабатывают энергию?
Короткий ответ — при помощи цикла Кребса и переноса электронов в дыхательной цепи. Не пугайтесь! Это значит, что для получения энергии митохондрии используют кислород и углеводы (сахар). Глюкоза, попадая внутрь митохондрии, «переупаковывается» в два важных компонента — пируват и никотинамидадениндинуклеотид (НАД). Эти два вещества транспортируются в центральную часть митохондрии, где в присутствии кислорода (это наиважнейший момент эффективной продукции энергии!) используются для выработки главного энергетического субстрата — АТФ. Правильнее рассматривать АТФ как валюту клетки, которая идет на оплату счетов за свет, воду, газ и электричество.
На каком языке говорят митохондрии?
Могут ли митохондрии передвигаться?
Популяционные генетические исследования
Практически полное отсутствие генетической рекомбинации в митохондриальной ДНК делает ее использование информации для ученых, занимающихся популяционной генетикой и эволюционная биология. Меры всяохондриальной ДНК наследуется как единое целое, или гаплотип, взаимосвязи между митохондриальной ДНК от разных людей представлены в виде гаплотипа. Паттерны в этих генных деревьях можно использовать для вывода эволюционной истории популяций. Классическим примером этого эволюционная генетика человека, где молекулярные часы люди для обозначения новой даты митохондриальной Евы. Это часто интерпретируется как решительная поддержка недавней экспансии современного человечества из Африки. Другой пример человека – это секвенирование митохондриальной ДНК из костей неандертальца. Относительно большое эволюционное расстояние между механизмами митохондриальной ДНК неандертальцев и живых людей было истолковано как свидетельство отсутствия межпородного скрещивания между неандертальцами и анатомически современными людьми.
Однако митохондриальная ДНК только история самок в населенном поселении. население и поэтому может не отражать историю населения в целом. Частично это можно преодолеть за счет использования отцовских генетических последовательностей, таких как нерекомбинирующий участок Y-хромосомы. В более широком смысле, только исследования, которые также включают ядерную ДНК, предоставляют полную эволюционную историю популяции.
Недавние измерения молекулярных часов митохондриальной ДНК сообщили о 1 мутации каждые 7884 лет, относящееся к последнему общему предку людей и обезьян, что согласуется с оценками частоты мутаций аутосомной ДНК (10 на основе поколения.
Как митохондрии управляют судьбой клетки?
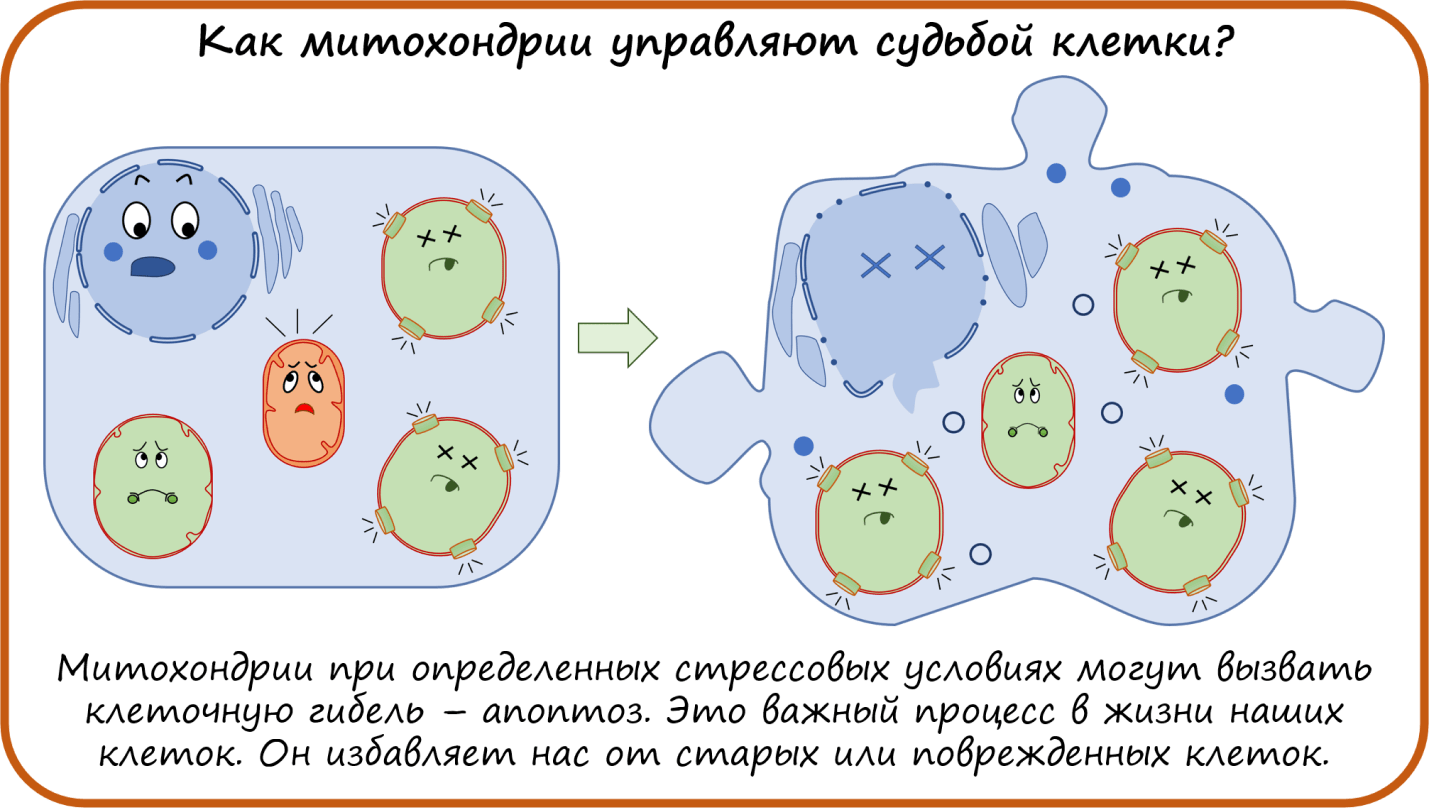
Вот мы и рассмотрели функции митохондрии как источника энергии и самонаводящейся ракеты при индукции апоптоза. Но кроме этого, митохондрии еще участвуют в синтезе белков, кофакторов, гормонов, нуклеотидов, что делает их еще более важными и ценными.
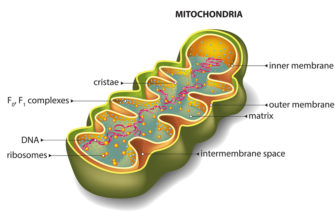
Структура

 1 Наружная мембрана 1,1 Порины 2 Межмембранное пространство 2,1 Внутрикристальное пространство 2,2 Периферийное пространство 3 Lamellæ 3.1 Внутренняя мембрана 3.11 Внутренняя граничная мембрана 3.12 Кристаллическая мембрана 3,2 Матрица 3.3 Cristæ 4 Митохондриальная ДНК 5 Гранула Matix 6 Рибосома 7 АТФ-синтаза Редактировать · Исходное изображение Ультраструктура митохондрий (интерактивная диаграмма) Митохондрия имеет двойную мембрану; внутренний содержит его хемиосмотический аппарат и имеет глубокие бороздки, увеличивающие площадь его поверхности. Хотя митохондрии обычно изображаются как «апельсиновая колбаса с каплей внутри» (как здесь), митохондрии могут принимать разные формы, а их межмембранное пространство довольно тонкое.
1 Наружная мембрана 1,1 Порины 2 Межмембранное пространство 2,1 Внутрикристальное пространство 2,2 Периферийное пространство 3 Lamellæ 3.1 Внутренняя мембрана 3.11 Внутренняя граничная мембрана 3.12 Кристаллическая мембрана 3,2 Матрица 3.3 Cristæ 4 Митохондриальная ДНК 5 Гранула Matix 6 Рибосома 7 АТФ-синтаза Редактировать · Исходное изображение Ультраструктура митохондрий (интерактивная диаграмма) Митохондрия имеет двойную мембрану; внутренний содержит его хемиосмотический аппарат и имеет глубокие бороздки, увеличивающие площадь его поверхности. Хотя митохондрии обычно изображаются как «апельсиновая колбаса с каплей внутри» (как здесь), митохондрии могут принимать разные формы, а их межмембранное пространство довольно тонкое.
Митохондрии содержат внешнюю и внутреннюю мембраны, состоящие из фосфолипидные бислои и белки. Две мембраны имеют разные свойства. Благодаря этой двухмембранной митохондрии, состоящей из пяти различных частей. Это:
- внешняя митохондриальная мембрана,
- межмембранное пространство (пространство между внешней и внутренней мембранами),
- внутренняя митохондриальная мембрана,
- кристы пространство (образовано складками внутренней мембраны) и
- матрикс (пространство внутри внутренней мембраны).
Митохондрии, лишенные своей внешней мембраны, представляют собой так называемые митопласты.
Наружная мембрана
внешняя митохондриальная мембрана, которая охватывает весь органеллу, имеет толщину от 60 до 75 Угрем (Å). Он имеет соотношение белков и фосфолипидов, аналогичное происхождение клеточной мембраны (примерно 1: 1 по весу). Он содержит большое количество интегральных мембранных белков, называемых поринами. Основным транспортным белком является порообразующий потенциалзависимый анионный канал (VDAC). VDAC является первичным транспортером нуклеотидов, первой и метаболитов между цитозолем и межмембранным пространством. Он сформирован в виде бета-ствола, который охватывает внешнюю мембрану, аналогично мембране грамотрицательных бактерий. Более крупные белки могут проникать в митохондрии, если сигнальная последовательность на их N-конце связывается с большим мультисубъединичным белком, называемым транслоказой на внешней мембране, который активно перемещает их через мембрану. Митохондриальные протеины импортируются через специализированные транслокационные комплексы.
Наружная мембрана также содержит ферменты, участвующие в таких разнообразных действиях, как удлинение жирных кислот, окисление эпинефрина, и разложение триптофана. Эти ферменты включают моноаминоксидазу, ротенон, -нечувствительную NADH-цитохром с-редуктазу, кинуренин гидроксилазу и жирную кислоту Co-A <382.>лигаза. Нарушение внешней мембраны позволяет протеинам из межмембранного пространства просачиваться в цитозоль, что приводит к гибели клеток. Наружная мембрана митохондрий может ассоциироваться с мембраной эндоплазматического ретикулума (ER) в структуре, называемой MAM (митохондриально-ассоциированная ER-мембрана). Это важно для передачи сигналов кальция в ER-митохондриях и участвует в переносе липидов между ER и митохондриями. С внешней внешней мембраны есть маленькие (диаметром 60 Å) частицы, называемые частичками Парсона.
Межмембранное пространство
митохондриальное межмембранное пространство – это пространство между внешней и внутренней мембранами. Оно известно также как перимитохондриальное пространство. Внешняя мембрана свободно проницаема для малых молекул, слабые молекулы, такие как ионы и сахара, в межмембранном пространстве такие же, как в цитозоле. Однако большие белки должны иметь определенную внешнюю сигнальную последовательность, чтобы транспортироваться через белковый состав, поэтому белковый состав отличается от белкового состава цитозоля. Один белок, локализованный таким образом в межмембранном пространстве, – это цитохром с.
Внутренняя мембрана
Внутренняя митохондриальная мембрана содержит белки с тремя типами функций:
- Те, которые выполняет цепь переноса электронов окислительно-восстановительные реакции
- АТФ-синтаза, которая генерирует АТФ в матрице
- Специфическая транспортные белки, которые регулируют переход метаболита в и из митохондриального матрикса
Он содержит более 151 различных полипептидов и имеет очень высокое содержание белка соотношение α-фосфолипидов (более 3: 1 по весу, что составляет примерно 1 белок на 15 фосфолипидов). Внутренняя мембрана содержит около 1/5 всего белка митохондрии. Кроме того, внутренняя мембрана богата необычным фосфолипидом кардиолипином. Этот фосфолипид был первоначально обнаружен в сердцах коров в 1942 году и обычно характерен для митохондриальных и бактериальных плазматических мембран. Кардиолипин содержит четыре жирные кислоты, а не две, и может помочь сделать внутреннюю мембрану непроницаемой. В отличие от внешней мембраны, внутренняя мембрана не содержит поринов и очень непроницаема для всех молекул. Практически все ионы и молекулы требуют специальных мембранных транспортеров для входа в матрицу или выхода из нее. Белки переносятся в матрикс через транслоказу внутренней мембраны (TIM) или через Oxa1. Кроме того, существует мембранный потенциал через внутреннюю мембрану, образованный действием ферментов цепи переноса электронов. Слияние внутренней мембраны опосредуется белком внутренней мембраны OPA1.
Cristae
 Изображение поперечного сечения крист в митохондриях печени крысы, демонстрирующее вероятную трехмерную структуру и взаимосвязь с внутренней мембраной
Изображение поперечного сечения крист в митохондриях печени крысы, демонстрирующее вероятную трехмерную структуру и взаимосвязь с внутренней мембраной
Внутренняя митохондриальная мембрана разделена на многочисленные кристы, которые увеличивают площадь поверхности внутренней митохондриальной мембраны, повышая ее способность производить АТФ. Для типичных митохондрий печени площадь внутренней мембраны примерно в пять раз больше внешней мембраны. Это соотношение варьируется, и митохондрии из клеток, которые имеют большую потребность в АТФ, таких как мышечные клетки, содержат еще больше крист. Митохондрии в одной и той же клетке могут иметь существенно разнуюплотность криста, те, которые необходимы для производства большего количества энергии, имеют гораздо большую поверхность криста-мембраны. Эти складки усеяны небольшими круглыми телами, известными как F1частицы или оксисомы. Это не простые случайные складки, а скорее инвагинации внутренних мембран, которые могут влиять на общую хемиосмотическую функцию.
Одно недавнее исследование с математическим моделированием показало, что оптические свойства кристов в нитчатых митохондриях может влиять на генерацию и распространение света в ткани.
Матрица
Матрица – это пространство, ограниченное внутренней мембраной. Он содержит около 2/3 всех белков митохондрии. Матрикс играет важную роль в производстве АТФ с помощью АТФ-синтазы, содержащийся во внутренней мембране. Матрикс содержит высококонцентрированную смесь сотен ферментов, специальных митохондриальных рибосом, тРНК и нескольких копий митохондриальной ДНК генома. Из ферментов основные функции включают окисление пирувата и жирных кислот, а также цикл лимонной кислоты. Молекулы ДНК упаковываются в нуклеоиды с помощью белков, один из которых TFAM.
. Митохондрии имеют собственный генетический материал и оборудование для производства собственных РНК и белков (см.: биосинтез белка ). Опубликованная последовательность митохондриальной ДНК человека выявила 16 569 пар оснований, кодирующих 37 генов: 22 тРНК, 2 рРНК и 13 пептид гена. 13 митохондриальных пептидов у человека интегрированы во внутреннюю митохондриальную мембрану вместе с белками, кодируемыми генами, находящимися в ядре <809 клетки-хозяина.>Митохондриально-ассоциированная мембрана ER (MAM)
Митохондриально-ассоциированная мембрана ER (MAM) – это еще один структурный элемент, который все больше признается за его критическую роль в клеточной физиологии и гомеостазе. Когда-то считавшиеся технические загвоздкой в методх клеточного фракционирования, предполагаемые контаминанты ER везикул, которые неизменно появлялись в митохондриальной фракции, были идентифицированы как мембранные структуры, происходящие из MAM – интерфейса между митохондриями и ER. Физическая связь между этими двумя органеллами ранее наблюдалась на электронных микрофотографиях, недавно была исследована с помощью флуоресцентной микроскопии. Такие исследования показывают, что в МАМ, который может составлять до 20% внешней митохондриальной мембраны, ЭПР и митохондрии разделены всего на 10-25 нм и удерживаются вместе белковыми связующими комплексами.
Очищенный МАМ от субклеточного фракционирования, как было показано, обогащается ферментами, участвующими в обмене фосфолипидов, в дополнение к каналу, с передачей сигналов Са. Эти намеки на выдающуюся роль MAM в регуляции клеточных липидных запасов и сигналов были подтверждены со значительными последствиями для митохондриально-ассоциированных клеточных явлений, как обсуждается ниже. МАМ не только предоставил понимание механистической, лежащей в основе таких физиологических процессов, как внутренний апоптоз и распространение кальциевых сигналов, но также основы более точному представлению о митохондриях. Хотя его часто рассматривают как статические, изолированные “ электростанции ”, используемые для метаболизма в результате древнего эндосимбиотического события, эволюция MAM подчеркивает степень интеграции митохондрий в общую физиологию клетки с тесным физическим и функциональным взаимодействием с эндомембранной системой.
Перенос фосфолипидов
МАМ обогащения ферментами, участвующими в биосинтезе липидов, такими как фосфатидилсеринсинтаза на поверхности ER и фосфатидилсерин декарбоксилаза на поверхности митохондрий. Предоставьте собой динамические механизмыеллы, подвергающиеся постоянно митющимся событиям деления и слияния, они требуют постоянного и хорошо регулируемого поступления фосфолипидов для целостности мембраны. Но митохондрии – это не только место назначения фосфолипидов, синтез которых они завершают; скорее, эта органелла также играет роль в межорганическом перемещении промежуточных продуктов биосинтеза фосфолипидов, метаболизма церамидов и холестерина и анаболизма гликосфинголипидов.
Такая способность к перемещению зависит от MAM, что было показано для облегчения переноса промежуточных липидов между органеллами. В противоположность стандартному везикулярному механизму переноса липидов, данные указывают на то, что физическая близость ER и митохондриальных мембран в MAM делает возможным переключение липидов между противоположными бислоями. Несмотря на этот необычный и, казалось бы, энергетически невыгодный механизм, такой транспорт не требует АТФ. Вместо этого было показано, что у дрожжей он зависит от связывания связывания мультипротеинов, называемой ER-митохондриальной структурой встречи, или ERMES, хотя остается неясным, напрямую ли эта структура опосредует перенос липидов или требуется для сохранения мембраны находиться в достаточно непосредственной близости, чтобы снизить энергетический барьер для липида переброса.
МАМ также может быть секреторным пути, своей ролью во внутриклеточном перемещении липидов. В частности, МАМ, по-видимому, является промежуточным местом назначения между грубым ER и Гольджи на пути, который ведет к липопротеину очень низкой плотности или ЛПОНП, сборке и секреции. Таким образом, МАМ наиболее важным метаболизма и транспортировки липидов.
Передача сигналов кальция
Критическая роль ER в передаче сигналов кальция была признана еще до того, как такая роль митохондрий получила широкое признание, отчасти из-за низкого сродства Са-каналов, локализованных к внешнему митохондриям. Мембрана, по-видимому, противоречит предполагаемой способности этого органеллы реагировать на изменения внутриклеточного потока Са. Но данная MAM способствует передаче Са от ЭР к митохондриям, что приводит к образованию микродоменов. Передача происходит в ответ на так называемые «затяжки Са», генерируемые спонтанной кластеризацией и активацией IP3R, канонического Са-канала мембраны ЭР.
Судьба этих затяжек – в частности, они остаются ограниченными изолированными местами или интегрированными волнами Ca распространения по клетке – в степени это определяется динамикой MAM. Хотя повторный захват Са ЭР (одновременно с его высвобождением) модулирует интенсивность затяжек, таким образом изолируя митохондрии до определенного эффекта воздействия Са, МАМ часто служит брандмауэром, по существу буферизует затяжки Са, действуя как сток в какие свободные ионы, созданные в цитозоль, могут быть задействованы. Это туннелирование Ca происходит через низкоаффинный рецептор Ca VDAC1, который, как недавно было показано, физически привязан к кластерам IP3R на мембране ER и обогащен в MAM. Способность митохондрий служить стоком Са является результатом электрохимического градиента, генерируемого время окислительного фосфорилирования, что делает туннелирование катиона экзергоническим процессом. Нормальный, умеренный приток кальция из цитозоля в митохондриальный матрикс вызывает временную деполяризацию, которая корректируется путем откачки протонов.
Но передача Са не является однонаправленной; скорее, это улица с двусторонним движением. Свойства кальциевого насоса SERCA и канала IP3R, присутствующего на мембране ER, способствуют регулированию обратной связи, координируемому функции MAM. В частности, клиренс Са посредством МАМ позволяет формировать пространственно-временныйтерн передачи сигналов Са, поскольку Са изменяет активность IP3R двухфазным образом. SERCA аналогичным образом зависит от обратной связи митохондрий: захвата СаМ стимулирует выработку АТФ, тем самым энергию, которая позволяет SERCA перезагружать ЭР Са для продолжения оттока Са в МАМ. Таким образом, МАМ не является пассивным буфером для затяжек с кальцием; скорее он помогает модулировать дальнейшую передачу сигналов Ca через петли обратной связи, которые влияют на динамику ER.
Регулирование высвобождения Са в ЭР в МАМ особенно важно, потому что только определенное наращивание Са поддерживает митохондрии и, следовательно, клетку в гомеостазе. Достаточная передача сигналов Са внутриорганелл необходим для стимуляции метаболизма активации ферментов дегидрогеназы, критических для прохождения цикла лимонной кислоты. Однако, как только передача сигналов Са в митохондриях преодолевает определенный порог, она частично стимулирует внутренний путь апоптоза за счет коллапса потенциала митохондриальной мембраны, необходимого для метаболизма. Исследования, изучающие роль систем и антиапоптотических факторов, следующие эту модель; Например, антиапоптотический фактор Bcl-2, как было показано, взаимодействует с IP3R, снижающим наполнение ЭР кальцием, что приводит к уменьшению оттока в МАМ и предотвращает постапоптотические стимулы стимулов митохондриальной мембраны. Учитывая потребность в такой тонкой регуляции передачи сигналов Са, возможно, неудивительно, что дисрегулируемый митохондриальный Са участвовал в нескольких нейродегенеративных заболеваниях, в то время как каталог опухолевых супрессоров включает несколько, которые обогащены MAM.
Молекный основа для привязки
Недавние успехи в идентификации привязок между митохондриальной и ER-мембрами предполагают, что поддерживающая функция используемых молекулярных элементов вторична по отношению к другим, неструктурным функциям. Мультибелковый комплекс взаимодействующих ER- и митохондриально-резидентных мембранных белков, необходимых для переноса липидов в MAM, демонстрирует этот принцип. Один из его компонентов, например, является составной частью белкового комплекса, необходимого для встраивания трансмембранных бета-стволовых белков в липидный бислой. Однако гомолог комплекса ERMES еще не идентифицирован в клетках млекопитающих. Другие белки, участвующие в каркасе, также имеют функции, независимые структурного связывания в МАМ; например, резидентные в ER и митохондрии митофузины образуют гетерокомплексы, которые регулируют количество контактов между органеллами, хотя митофузины были впервые идентифицированы по их роли в событиях деления и слияния между отдельными митохондрии. Связанный с глюкозой белок 75 (grp75) является другим белком с двойной функцией. В дополнение к матричному пулу grp75, часть служит шапероном, который физически связывает митохондриальные и ER Са каналы VDAC и IP3R для эффективной передачи Са в МАМ. Другим потенциальным связующим звеном является Sigma-1R, неопиоидный рецептор, стабилизация ER-резидентного IP3R которого может быть коммуникацию в МАМ во время реакции на метаболический стресс.
 Модель дрожжевого мультимерного связывающего комплекса, ERM
Модель дрожжевого мультимерного связывающего комплекса, ERM
Перспектива
МАМ является важным центром передачи сигналов, метаболизма и трафика в клетке, который позволяет интегрировать ER и физиологию митохондрий. Связь между этим органеллами является не только структурной, но также функциональной и имеет решающее значение для общей клеточной физиологии и гомеостаза. Таким образом, MAM предлагает взгляд на митохондрии, который расходится с традиционным взглядом на эту органеллу как на статичную изолированную единицу, приспособленную для ее метаболической способности клеткой. Напротив, этот интерфейс митохондрий-ER подчеркивает интеграцию митохондрий, продукта эндосимбиотического события, в разнообразные клеточные процессы. Недавно было также показано, что митохондрии и MAM-ы в нейронах прикреплены к специализированным участкам межклеточной коммуникации (так называемые соматические соединения). Процессы микроглии контролируют и защищают функции нейронов на этих участках, и предполагается, что MAM-ы играют важную роль в этом типе контроля качества клеток.
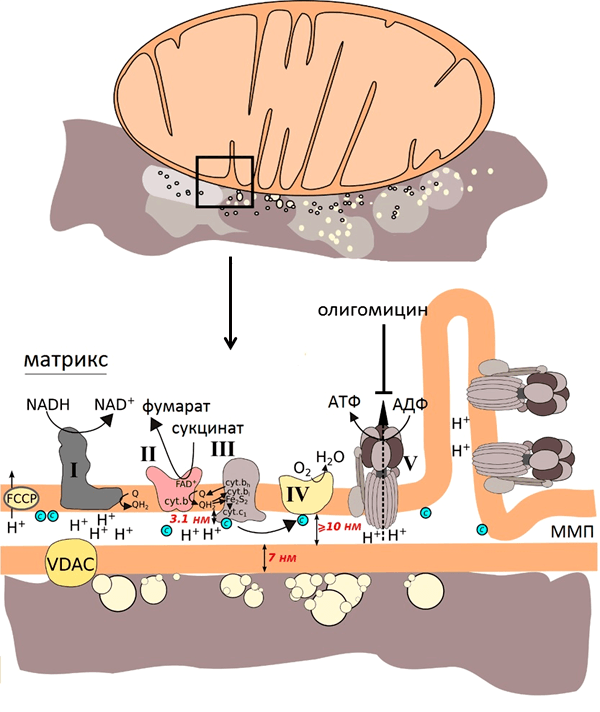
Долгожданный спектр ГКР митохондрий
Жалюзи опущены. Выключен свет. Комната погружена во мрак. Капля суспензии падает на серебряную подложку. Вспышка зелёного света. 30 секунд. Спектр. Тот самый долгожданный спектр ГКР от изолированных сердечных митохондрий был получен! Оставалось только понять, от каких именно структур в митохондриях исходит сигнал.
С учётом размеров компонентов митохондрий (рис. 7) и того, что усиление наблюдается на расстоянии нескольких нанометров от наноструктур, можно было предположить, что спектр ГКР митохондрий будет преимущественно спектром цитохрома с, так как этот цитохром наиболее близко подходит ко внешней мембране митохондрий и, соответственно, к наноструктурам. В то же время остальные цитохромы закреплены в комплексах внутренней мембраны.
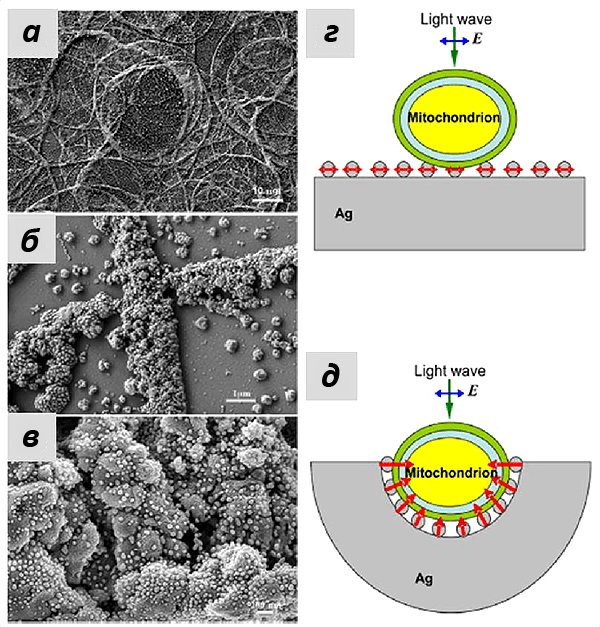
Это утверждение также подтверждалось при моделировании эффектов усиления КР серебряными наноструктурами, которые были использованы в работе. Группа наших коллег из лазерного центра Ганновера показала, что сложная морфология подложки со множеством углублений, в которые могут попадать митохондрии, позволило получать усиление на большом расстоянии (более 10 нм). А иерархическое устройство самих наноструктур увеличивало число мест контакта с мембраной митохондрий и, следовательно, число молекул цитохрома с, от которых можно было зарегистрировать сигнал ГКР. Если использовать те же наночастицы серебра, просто присоединенные к плоской подложке, то особого усиления не произойдет, что и подтверждалось в эксперименте (рис. 8).
И действительно, полученный спектр ГКР митохондрий соответствовал спектрам цитохрома с! При использовании зелёного лазера в качестве возбуждающего света можно регистрировать сигнал только от цитохромов b и с, но не от цитохрома а, что облегчает задачу расшифровки спектров. Несмотря на схожесть структуры цитохромов типа b и с, они имеют ключевые пики на спектре, благодаря которым их нельзя перепутать (рис. 9). Таким образом, используемые наноструктуры давали усиление на достаточно большом расстоянии, чтобы зарегистрировать спектры от цитохрома с, но недостаточно большом, для того чтобы увидеть пики цитохромов b. И это как раз то, что нужно! Благодаря методу ГКР теперь можно исследовать селективно редокс-состояние и конформацию именно цитохрома с в живых функционирующих митохондриях.
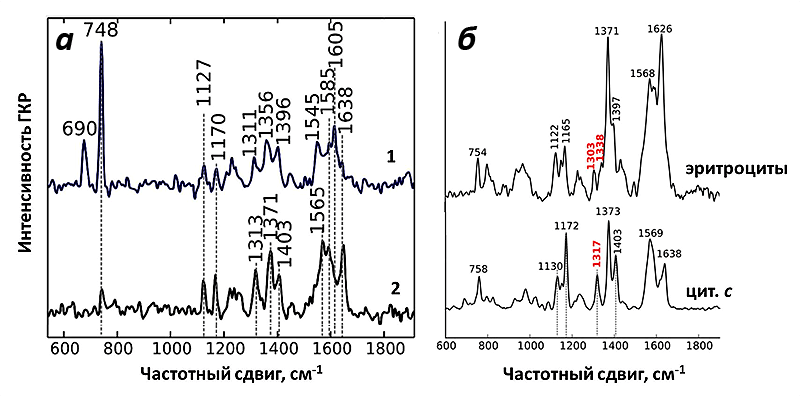
Как и ожидалось, спектры ГКР цитохрома с митохондрий оказались очень чувствительны к изменению его окислительно-восстановительного состояния. Для этого было исследовано два воздействия: внесение протонофора FCCP и ингибитора АТФ-синтазы олигомицина.
Таким образом, спектры ГКР митохондрий, являясь спектрами исключительно цитохрома с, оказались чувствительны к изменениям его конформации и редокс-состояния в процессе работы митохондрий.
Схема всей работы в одном ролике