Как устроены митохондрии?

Как всё устроено
* — Окислительно-восстановительный потенциал — синоним редокс-потенциала (от англ. reduction — восстановление, oxidation — окисление).
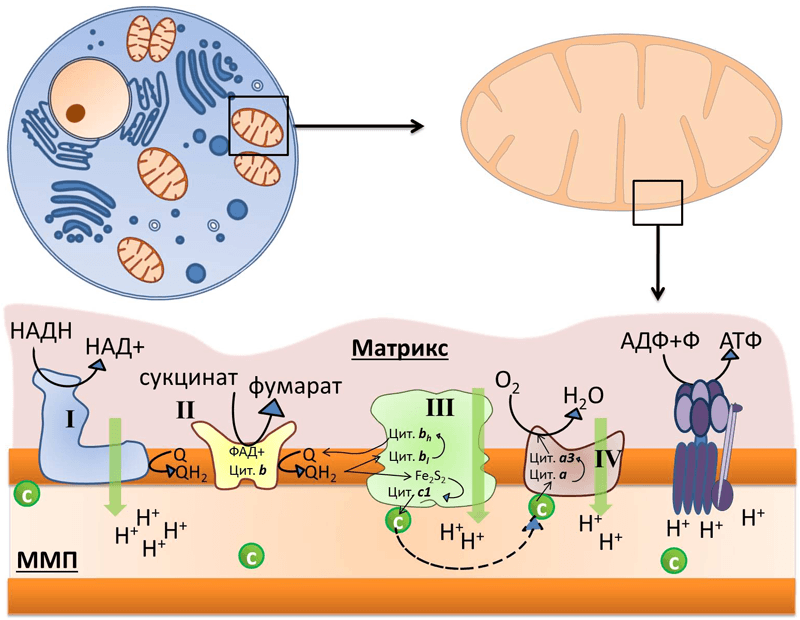
Рисунок 1. Во внутренней мембране митохондрий локализованы комплексы дыхательной цепи: I — НАДН-дегидрогеназа, II — сукцинат-дегидрогеназа, III — цитохром b–c1-комплекс, или цитохром с-редуктаза, IV — цитохром а–а3, или цитохромоксидаза, и фермент АТФ-синтаза. Q — убихинон, «с» в зелёном кружке — цитохром с. Чёрными стрелками показан транспорт электрона, пунктирной стрелкой — диффузия цитохрома с от комплекса III к IV, зелеными стрелками — перенос протона.
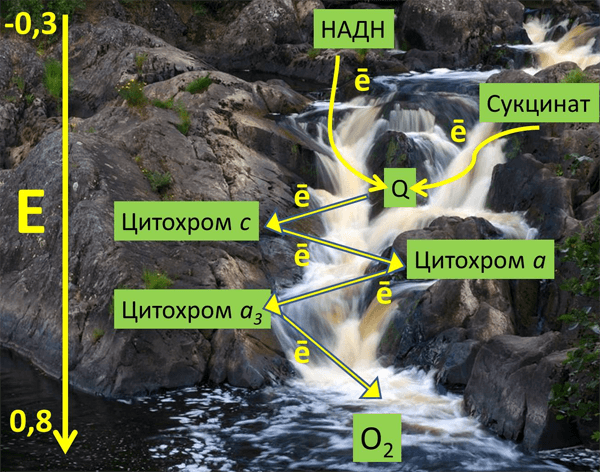
Рисунок 2. Метафорическое изображение среднеточечных редокс-потенциалов различных переносчиков ЭТЦ митохондрий в энергетической шкале (вольт) на фоне реки Тохмайоки в Карелии.
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Термин «митохондрия» произошел от сочетания двух греческих слов: «митос», что означает «нить» или «волокно», и «хондрос» – «зерно» или «крупица». Конечно, такое название вообще не отражает функции митохондрий. Связано это с тем, что впервые их описали еще в 1850 году. Исследователи увидели в мышечных клетках хорошо различимые овальные органеллы – отдельные, явно отграниченные включения в цитоплазме. Также была видна и их внутренняя структура, состоящая из каких-то полос и точек. Но что это такое и зачем оно нужно, тогда никто не знал, потому и название дали исключительно по внешнему виду. А понимание критически важной роли митохондрий для жизни клетки и всего нашего организма появилось только спустя почти столетие – в 1948 году.
Усиливая сигнал
Идея пришла от О.В. Сосновцевой, профессора Копенгагенского университета, с которой наша лаборатория сотрудничает не первый год. Она даже предложила «подсобить» с митохондриями, так как с ними работали в соседней лаборатории, и они готовы были поделиться.
Чего боится митохондрия?
Итак, мы разобрались, как митохондрии производят АТФ. Причем количество АТФ должно очень тонко регулироваться клеткой. Если потребности в АТФ выросли, его надо произвести больше. Например, при активной мышечной или умственной работе требуется больше АТФ. И наоборот, если клетка в спокойном состоянии, то и не надо тратить ресурсы понапрасну. Но как митохондрия понимает, когда простимулировать работу ЭТЦ, а когда — притормозить?
Поддерживать работу ЭТЦ на определенном уровне важно еще и потому, что ЭТЦ обеспечивает постоянство мембранного потенциала. Если мембранный потенциал слишком низкий, в митохондрии нарушается транспорт веществ. Но и слишком большой потенциал — это тоже плохо. Это значит, что в межмембранном пространстве митохондрий накопилось слишком много протонов. Перенос каждого следующего протона оказывается сильно затруднен. А перенос электронов, как мы помним, сопровождается закачкой протонов в межмембранное пространство. Без движения протонов через мембрану не будет и движения электронов вдоль мембраны. Поэтому электроны оказываются на долгое время «заперты» в своих комплексах ЭТЦ. И там-то их может схватить кислород. В таком случае образуется не безобидная вода, а активные формы кислорода (АФК, или кислородные радикалы), которые разрушают все на своем пути. В первую очередь, это супероксид-анион радикал (О2*—) и перекись водорода (Н2О2). Накопление таких агрессивных соединений провоцирует окислительный стресс — губительное состояние для тканей.
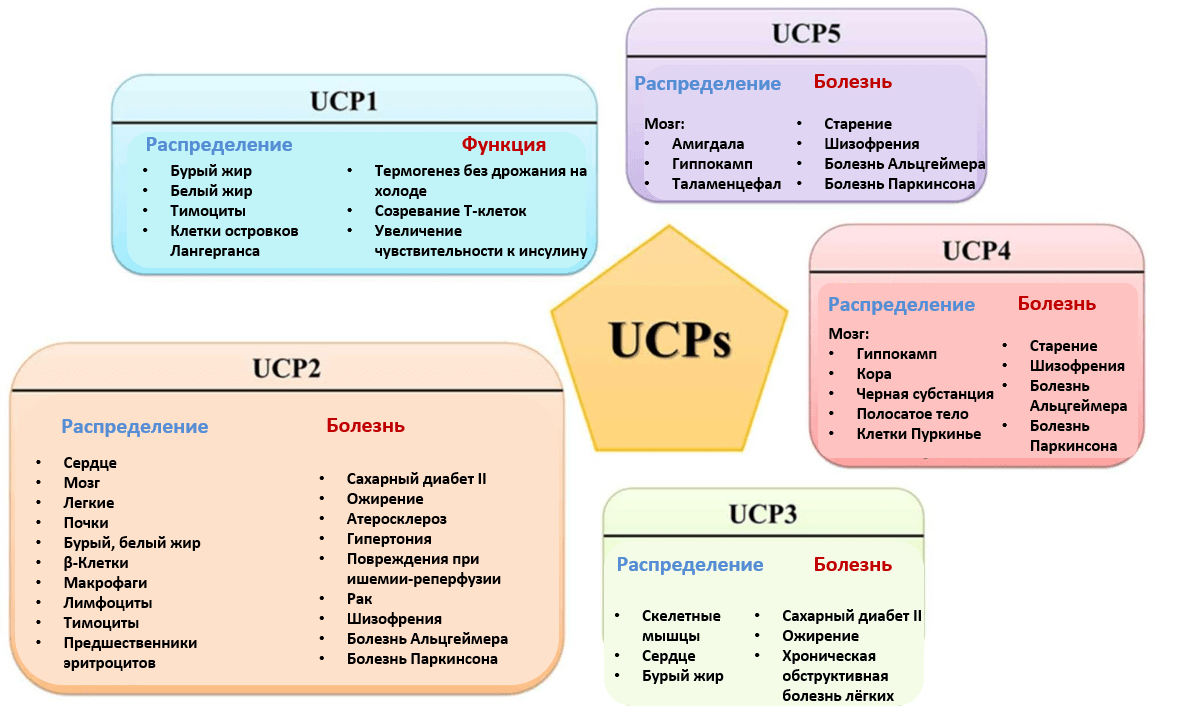
Рисунок 4. Семейство белков-разобщителей электронного транспорта и синтеза АТФ (UCPs — uncoupling proteins).
Другой способ снизить потенциал на мембране митохондрий — это увеличить пул НАД+. Как это работает? Комплекс I ЭТЦ окисляет НАДН (то есть отбирает у него электроны), в результате чего электроны поступают в ЭТЦ для создания мембранного потенциала и производства АТФ, а НАДН превращается в НАД+. Однако, комплекс I «чувствует» баланс НАД+/НАДН, и при нарушении баланса, в данном случае — увеличении количества НАД+, комплекс I перестает окислять НАДН. Без притока электронов с молекул НАДН протоны не закачиваются в межмембранное пространство, и мембранный потенциал митохондрий снижается.
В клетках существуют собственные антиоксидантные системы. Например, фермент супероксиддисмутаза преобразует опасный супероксидный анион радикал (О2*—) в кислород и пероксид водорода. Пероксид водорода тоже считается АФК, которая может вызвать окислительный стресс. Для его утилизации работает фермент каталаза, разлагающий пероксид водорода до воды и кислорода.
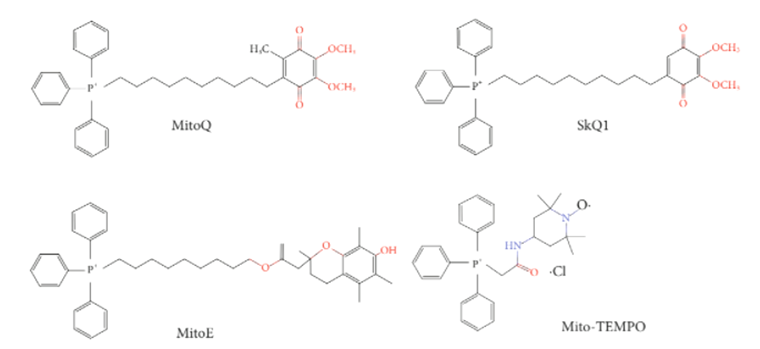
Рисунок 5. Антиоксиданты, соединенные с липофильными катионами.
Итак, мы рассмотрели, как устроена ЭТЦ митохондрий, как производится АТФ, зачем нам нужен кислород. Но в жизни все не так просто, как на картинке. Комплексы ЭТЦ могут еще и объединяться в суперкомплексы — так называемые респирасомы (рис. 6).
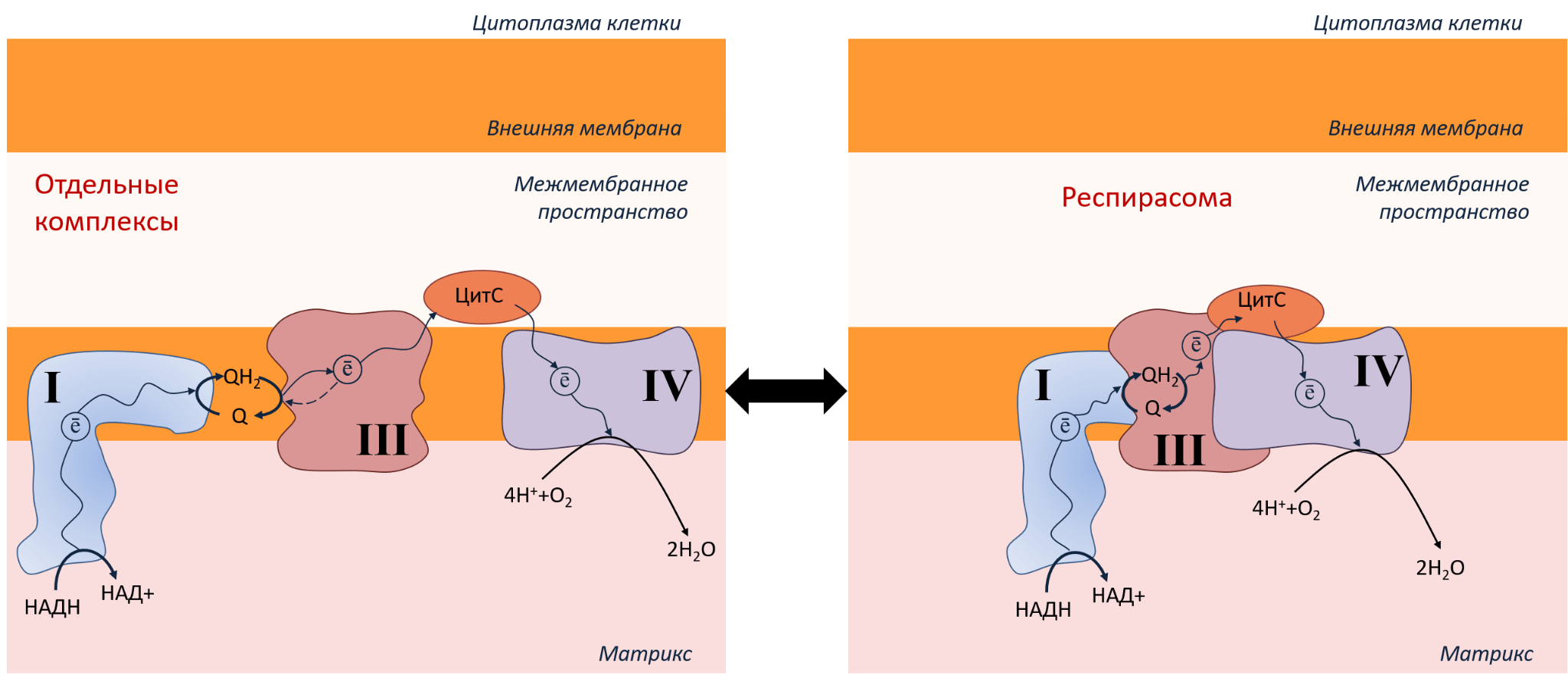
Рисунок 6. ЭТЦ в митохондриях может быть организована в виде отдельных комплексов (слева) или в виде респирасомы (справа). Переход из одного состояния в другое зависит от типов клеток и условий.
Респирасомы повышают эффективность переноса электрона по комплексам ЭТЦ, что ускоряет производство АТФ и снижает энергетические потери. Белки держатся внутри комплекса благодаря нескольким механизмам:
- за счет электростатических взаимодействий: если на поверхности одного комплекса расположены аминокислоты с положительным зарядом, а на поверхности другого комплекса — аминокислоты с отрицательным зарядом, то такие комплексы лучше удерживаются вместе;
- при участии особого липида, который есть только во внутренней мембране митохондрий — кардиолипина (несмотря на название, он есть не только в сердце, но и во всех митохондриях, а также у бактерий). Рассмотрим его роль подробнее.
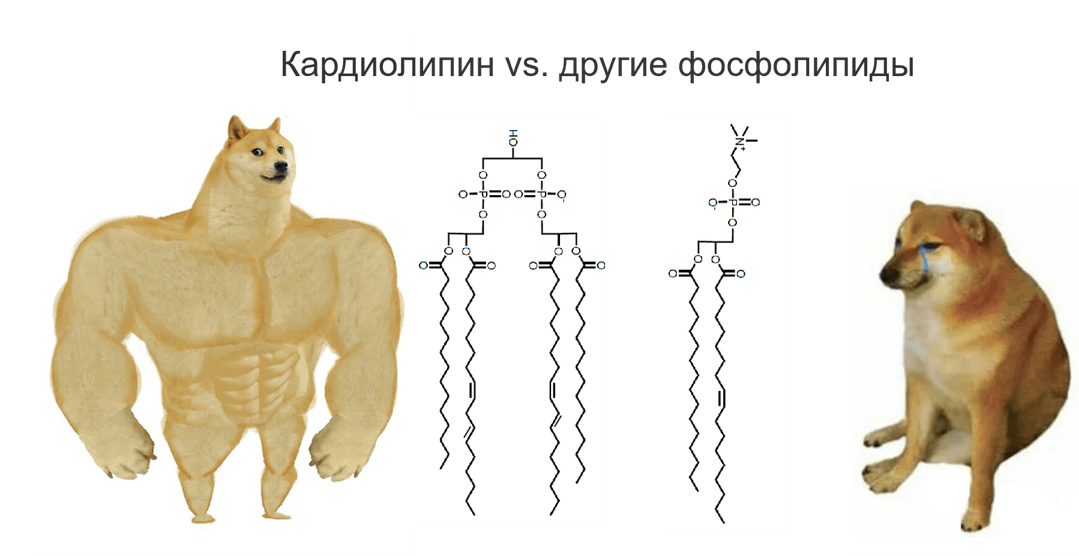
Рисунок 7. Принцип строения кардиолипина и других фосфолипидов.
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
О митохондриях и их функциях
Нет такой возрастной патологии, в которой бы не играла ключевую роль митохондриальная дисфункция. Если ваши митохондрии нормально обновляются и не продуцируют излишне много активных форм кислорода (АФК) — значит, скорее всего, вы молоды, здоровы и счастливы.
Сегодня ученые утверждают (и у нас нет повода им не доверять), что митохондрии — это биоэнергетический, биосинтетический и сигнальный центр клетки. Если обобщить, то вот какие функции они выполняют:
- энергетическую;
- сигнальную;
- синтетическую;
- участвуют в процессе запрограммированной клеточной гибели — апоптозе;
- иммунную.
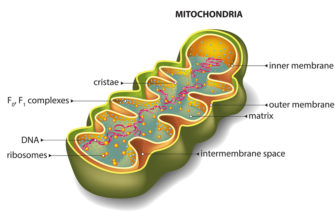
Митохондрии (рис. 1) — полуавтономные органеллы клетки. Они имеют две мембраны и собственный наследственный материал в виде кольцевой молекулы ДНК. ДНК митохондрий содержит всего 37 генов и кодирует 13 белков, что составляет около 1% от их общей потребности. Именно наличие собственного генетического материала — главное свидетельство «бактериального прошлого» митохондрии. Остальные гены в ходе длительного существования внутри клетки «перебрались» в ядро, и ядерная ДНК обеспечивает митохондрии подавляющим количеством белков, необходимых для их работы. Митохондрии нужны белки, которые кодируются и ядерной, и собственной ДНК, поэтому для нормального функционирования клетки необходимо безоговорочное «взаимопонимание» между ядром и митохондриями. Поэтому митохондрии способны как анализировать сигналы, поступающие от ядра, так и передавать ему сигналы в процессе ретроградного сигналинга. Важную роль в коммуникации ядра и митохондрий играют свободные радикалы, но об этом мы поговорим чуть позже, а сначала — об основных функциях митохондрий.
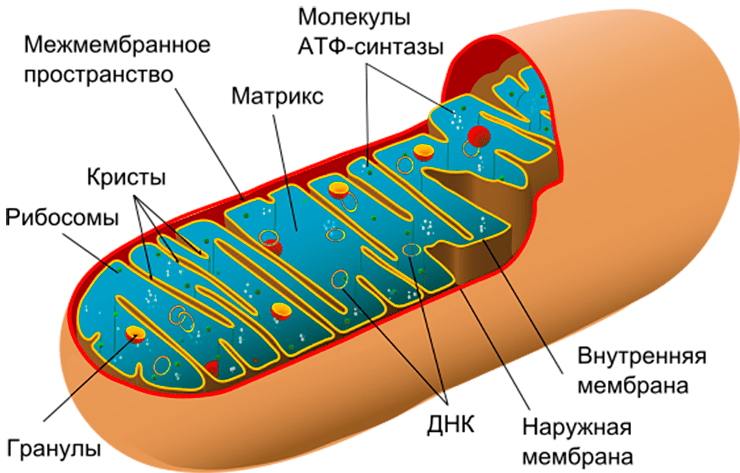
Рисунок 1. Строение митохондрии. Помимо собственной ДНК, в митохондриях есть две мембраны — внешняя и внутренняя. Внутренняя мембрана образует выросты — кристы, — и именно на ней расположена дыхательная цепь, которая обеспечивает запасание энергии в виде молекулы АТФ.
Энергии не занимать!
Из курса физики мы знаем, что ток — это направленный поток электронов. Дыхательная цепь митохондрий представляет собой цепь переноса электронов (рис. 2). Только вместо проводов во внутренней мембране расположена целая система трансмембранных белков (комплексов дыхательной цепи) и специальных переносчиков электронов, которые обеспечивают их направленный поток. Представить этот процесс можно в виде передачи пожарными друг другу ведер с водой. При этом комплексы и переносчики расположены таким хитрым образом, что при переходе электрона от одного к другому происходит выделение энергии в цепи окислительно-восстановительных процессов. Примерно, как если бы ведро с водой пожарные передавали своим товарищам, стоящим ниже на ступеньках (согласитесь, это гораздо легче, чем передавать его вышестоящим). Во внутренней мембране одной митохондрии находятся десятки тысяч полных дыхательных цепей.
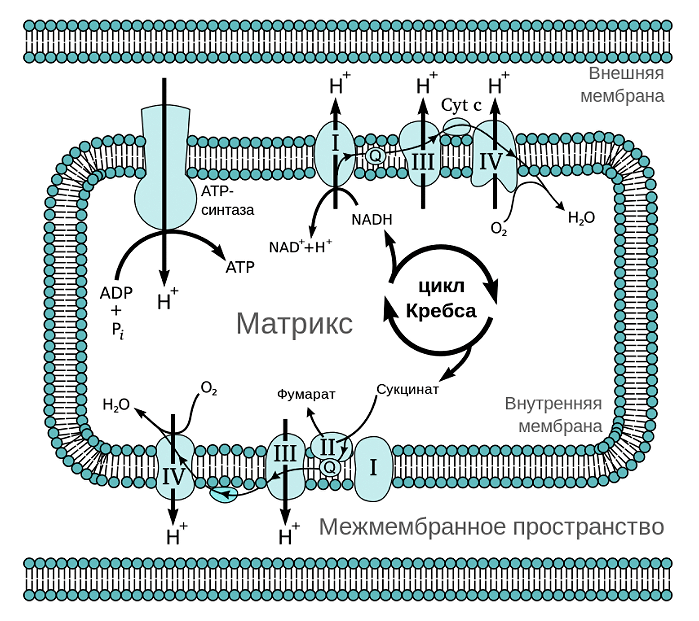
Рисунок 2. Дыхательная цепь митохондрий. Всего различают четыре комплекса дыхательной цепи, имеющих довольно сложные названия: НАДН-дегидрогеназа (I), сукцинатдегидрогеназа (II), цитохром-С-оксидоредуктаза (III) и цитохром-С-оксидаза (IV). Электрон передается от комплекса I или II к комплексу III, а от него — к комплексу IV. Передача электрона происходит при помощи специальных переносчиков, самым известным из которых это кофермент Q.
Откуда берется электрон, который «путешествует» по цепи переносчиков внутренней мембраны митохондрий? А берется он из водорода. Если помните, водород — очень простой атом. Он состоит всего из одного протона и одного электрона. Водород мы получаем из молекул, которые потребляем с пищей. Будь то жирные кислоты или глюкоза — в конечном счете, после ряда биохимических процессов и превращений, специальный переносчик (НАДН или ФАДН2) доставляет к дыхательной цепи заветный атом водорода, который даст протон Н+ и электрон.
Казалось бы, всё просто? Так куда же девается протон (Н+), когда электрон отправляется в путешествие по цепи переносчиков? Этот вопрос долго не беспокоил ученых.
Длительное время после открытия комплексов дыхательной цепи тайна дыхания казалась разгаданной. Химия тогда была в большом почете, окислительно-восстановительные реакции активно изучались. Только одно оставалось неясным — переносчик электрона к АТФ-синтазе так и не был обнаружен. И только хемиосмотическая теория, предложенная Питером Митчеллом, пролила свет на тайну дыхания и показала, что такого переносчика просто не существует, а в образовании энергии ключевую роль играет не химия ферментов, а физика мембран.
АТФ-синтаза — еще один компонент внутренней мембраны митохондрий. Это настоящий наномоторчик, который на фотографиях электронного микроскопа и на молекулярных моделях (рис. 3) напоминает гриб. Именно в результате работы АТФ-синтазы образуются молекулы АТФ. Как же это происходит? Та энергия, которая образовалась в окислительно-восстановительных реакциях переноса электронов, идет вовсе не на синтез АТФ, а на «выкачивание» протонов Н+ в пространство между двумя мембранами митохондрий. Когда их там оказывается достаточно, мембрана становится заряженной, как аккумулятор. То есть на внутренней мембране митохондрии возникает электрохимический градиент (он же — мембранный потенциал). Вернуться внутрь митохондрии протоны могут только через АТФ-синтазу (видео 1).
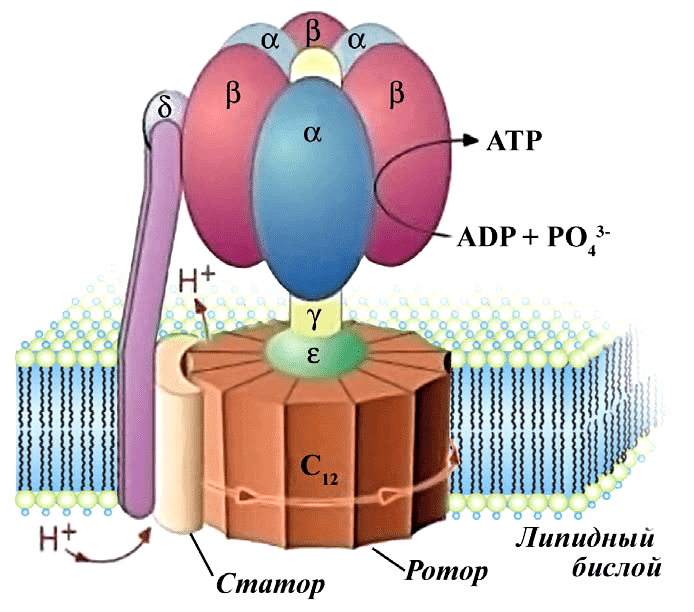
Рисунок 3а. Строение АТФ-синтазы. АТФ-синтаза представляет собой комплекс ферментов, объединенных в несколько субъединиц.
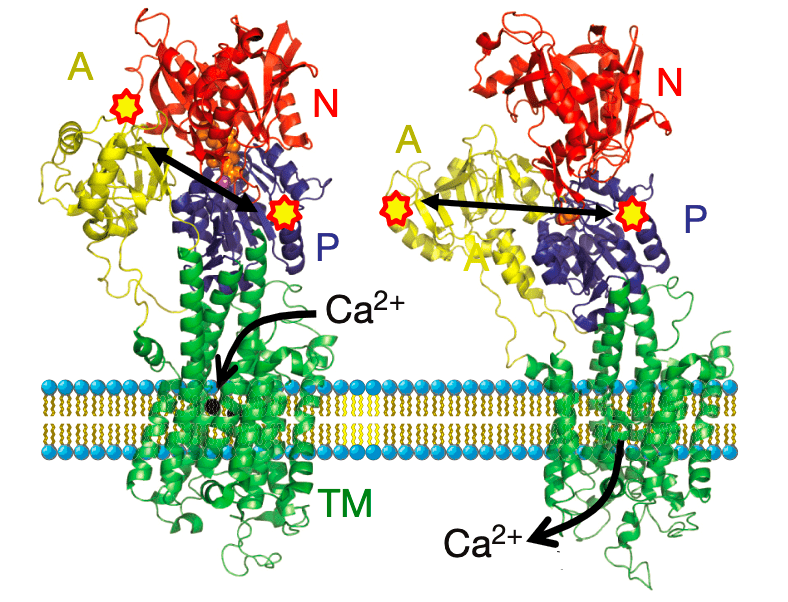
Рисунок 3б. Кристаллографическая модель Ca-АТФ-синтазы
Видео 1. Работа электрон-транспортной цепи и АТФ-синтазы. Представьте себе, как вода, падая с высоты, вращает колесо гидротурбины. Нечто похожее происходит и тут: протоны «вращают» ротор АТФ-синтазы. У людей для каждого полного оборота головки нужны девять протонов; при этом образуются три молекулы АТФ.
Неспаренный электрон — это всегда неспокойно. Он постоянно находится в поисках пары, поэтому пытается ее отобрать у других молекул, приводя к образованию всё новых свободных радикалов, которые могут повреждать макромолекулы (ДНК, липиды, белки).
Вам письмо!
Хотя митохондрии называют полуавтономными органеллами, в их ДНК закодировано всего 13 белков. Поэтому они должны обмениваться с ядром сигналами, говорящими об их потребностях и влияющими на активность генов. Ретроградный сигналинг, который мы уже упоминали, активно изучают, ведь его нарушение приводит к поломкам митохондрий и последующему старению или гибели клетки.
На каком же языке «разговаривают» митохондрии? Существует несколько путей коммуникации митохондрий с ядром. Мы приведем лишь некоторые из них:
Кроме производства энергии и функций, которые мы уже обсудили, митохондрии исполняют роль «цепного пса» иммунитета — помогают клеткам противостоять атакам бактерий, вирусов и грибов. Кроме этого, митохондрии следят «за порядком в доме». При нахождении клеточных повреждений митохондрии активируют врожденные иммунные реакции, в том числе воспаление. Так организм защищается от внешней и внутренней опасности, реагируя на нарушение гомеостаза.
При травмах, повреждении тканей и гибели клеток в кровь попадают схожие с PAMP молекулярные фрагменты, которые также запускают иммунный ответ. Они носят название DAMP (damage associated molecular patterns) — например, фибриноген, гистоны или мтДНК.
Атака на вирусы

Рисунок 4. Механизм действия белка MAVS. Распознав патоген, MAVS меняет конформацию и запускает сигнальный каскад, стимулирующий производство интерферонов типа I и других провоспалительных цитокинов для предотвращения репликации вирусов.
Роль митохондрий в противовирусной защите этим не ограничивается. Многие вирусы, попадая в клетку, воздействуют на митохондрии и их динамику (в норме митохондрии всё время делятся и сливаются) и приводят к дисфункции этих органелл (рис. 5). Есть разные мнения насчет того, делают ли они это в своих «корыстных» целях, или же это происходит по выработанному эволюцией механизму, поскольку нередко для вирусов такая стратегия оказывается губительной.
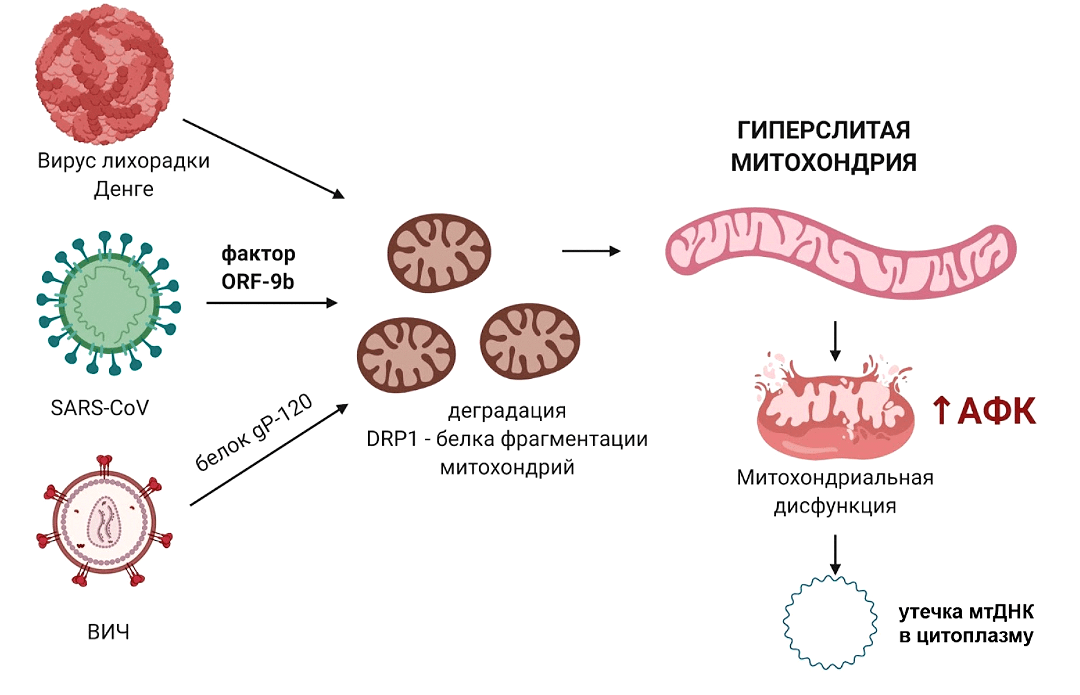
Рисунок 5. Воздействие вирусов на митохондрии при вторжении в клетку. Вирус SARS-CoV имеет фактор вирулентности ORF-9b, который приводит к деградации DRP1 (белка, который отвечает за фрагментацию митохондрий) и к гиперслиянию митохондрий. Белок ВИЧ gp120 также вызывает снижение уровня DRP1. Вирус лихорадки Денге фактически растворяет митохондриальную мембрану. Вирусные белки вначале колонизируют мембрану эндоплазматического ретикулума, формируя каркас, необходимый для репликации РНК вируса, а затем вступают в контакт с находящейся рядом мембраной митохондрий и делают в ней «дырку». Это ведет к нарушению нормальной работы митохондрий, повышению уровня АФК, дальнейшему повреждению мембраны митохондрий и утечке мтДНК в цитоплазму.
Почему же такая стратегия часто вредит вирусам? Она вызывает утечку мтДНК в цитоплазму. Это, с одной стороны, приводит к митохондриальной дисфункции, но с другой — стимулирует противовирусный иммунитет (рис. 6).
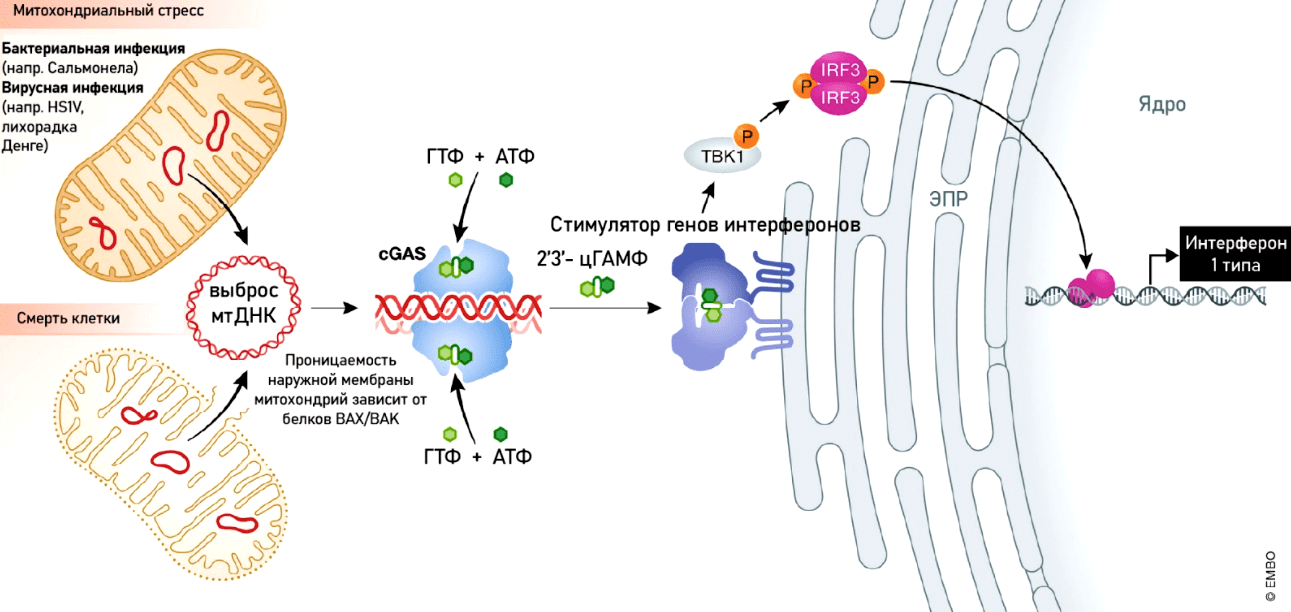
Рисунок 6. Механизмы, активируемые при разрушении митохондрий. Разрушение митохондрий вызывает выход мтДНК в цитоплазму и запускает иммунный ответ через путь cGAS-STING. Это компонент врожденной иммунной системы, который позволяет обнаружить ДНК в цитоплазме и в ответ запускает экспрессию провоспалительных генов. ДНК распознается особым белком — циклической ГМФ-АМФ синтазой (cGAS), которая запускает превращение ГМФ и АМФ в 2′3′-цГАМФ. Он, в свою очередь, связывается со стимулятором генов интерферонов (stimulator of interferon genes, STING) и активирует каскад фосфорилирования транскрипционных факторов, что приводит к синтезу интерферонов I типа.
Таким образом, митохондрии, как истинные «охранные псы», включают клеточную сигнализацию, жертвуя собой.
И бактерии тоже победим!
Митохондрии реагируют на вторжение в клетку не только вирусов. Они, некогда сами будучи бактериями, могут противостоять вторжению своих «диких сородичей».
Митохондрии участвуют в таком необычном способе защиты от патогенов, как «внеклеточные ловушки». Этот механизм был открыт в 2004 году учеными Института инфекционной биологии имени Макса Планка (Берлин, Германия) (рис. 7а). Кроме того, мтДНК играет важную роль в «системе оповещения» о внедрении патогена. Как уже было сказано выше, она представляет собой один из DAMP и связывается с рецептором TLR9 внутри клетки. Воздействие патогена стимулирует выделение внеклеточных везикул с мтДНК (рис. 7б), в результате чего активируются антибактериальные и провоспалительные сигнальные пути.
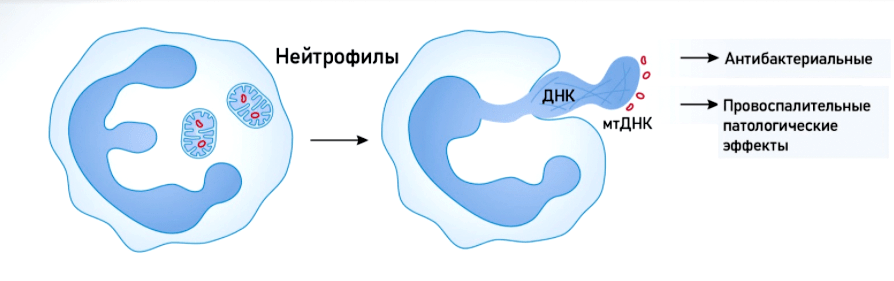
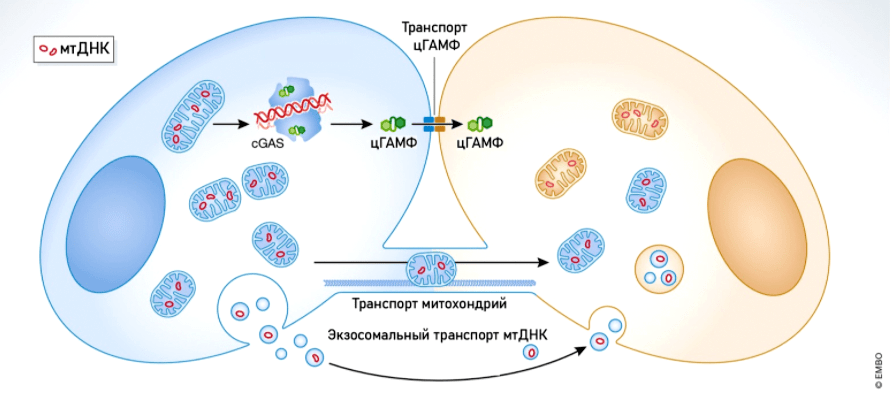
Рисунок 7б. мтДНК, заключенная в везикулы, или даже целые митохондрии, попадает в соседние клетки, передавая таким образом сигнал о вторжении патогена в организм
Повреждение митохондрий при вторжении патогенов, сопровождающееся выделением мтДНК и увеличением производства АФК, — мощный стимулятор воспаления. Но совсем иначе складывается ситуация, когда врожденный иммунитет стимулируют не вторгшиеся патогены, а клеточный «мусор». Тогда аномальное накопление поврежденных митохондрий и высвобождение мтДНК в цитозоль становятся причиной различных воспалительных заболеваний и усиления хронического возрастного воспаления. Об этом мы и поговорим далее.
Воспаление и митохондрии
Мы уже упоминали, что помимо компонентов вирусов и бактерий воспаление могут запускать молекулярные фрагменты собственных клеток.
Необходимо помнить, что компоненты митохондрий являются достаточно мощными DAMPs. Ученые полагают, что это связано с бактериальным прошлым митохондрий. Пока митохондрии здоровы и находятся внутри клетки, окруженные двойной мембраной, они не привлекают к себе никакого внимания иммунитета. Но как только мембрана митохондрий повреждается, а мтДНК выходит из митохондрии, запускается воспалительная реакция. Какие же компоненты митохондрий относятся к DAMP?
- Кардиолипин — фосфолипид, который у нас и у других эукариот в норме находится только во внутренней мембране митохондрий, где он и синтезируется. Также он часто встречается среди компонентов мембран бактерий (тест на наличие антител к кардиолипину проводят, например, при подозрении на сифилис).
- Формил-пептиды. Синтез белков в митохондриях, как и у бактерий, всегда начинается с особой модифицированной аминокислоты — N-формилметионина. У нас эта аминокислота при синтезе белка не используется. Поэтому наличие N-формилметионина на конце белковой молекулы (или на концах более коротких молекул — формил-пептидов, образующихся при распаде бактериальных белков) — надежный индикатор присутствия бактерий в организме.
- АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в клетке. Мы обычно считаем, что чем АТФ больше — тем лучше. На самом деле свободной АТФ в единичный момент времени в клетке находится очень мало. Бóльшая часть этой молекулы связана и находится в комплексе с магнием.
- Митохондриальная ДНК (мтДНК), вне всякого сомнения, один из важнейших DAMP, поскольку очень похожа на бактериальную ДНК. Она также кольцевая, и тоже содержит характерные «бактериальные последовательности» — неметилированные участки соседствующих нуклеотидов — цитозина и гуанина (CpG-сайты). В нашем ядерном геноме, как и у других млекопитающих, такие участки ДНК обычно подвергаются метилированию, поэтому появление мтДНК в крови воспринимается иммунной системой как опасность.
Роль митохондрий в запуске воспаления не ограничивается тем, что врожденный иммунитет воспринимает их компоненты как DAMPs. Важно помнить, что мтДНК и кардиолипин приводят к активации сборки инфламмасомы (рис. 8).
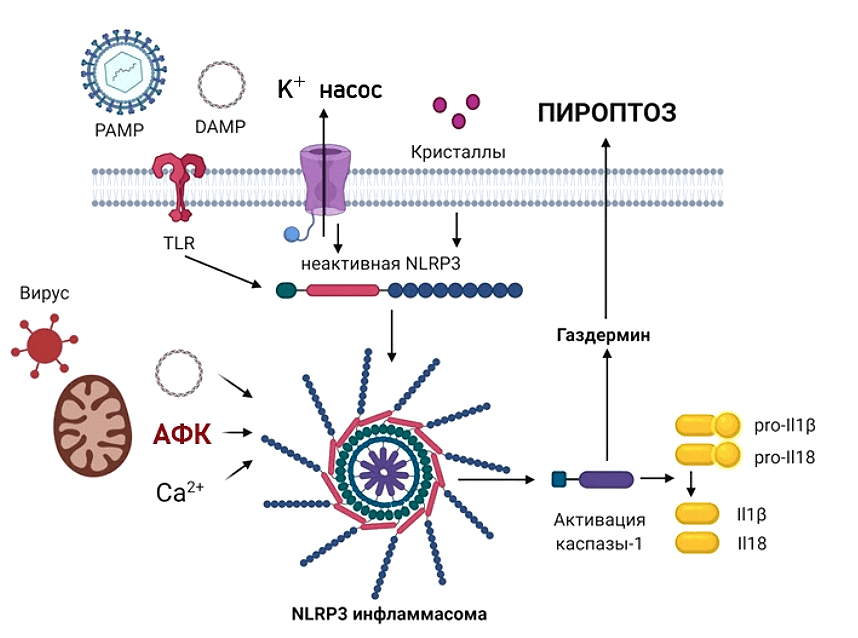
Рисунок 8. Активация инфламмасомы. NLRP3-инфламмасома обнаруживает микробные вещества и стимулирует «стерильное воспаление», возникающее без воздействия внешних факторов. При отсутствии угрозы в клетке инфламмасома находится в «разобранном состоянии». Молекулярный путь ее активации проходит в два этапа — активация (осуществляется нашими знакомыми сигналами PAMP или DAMP) и сборка. Инфламмасома запускает превращение прокаспазы-1 в каспазу-1 (протеолитический фермент, играющий важнейшую роль в воспалении) и последующую секрецию провоспалительных цитокинов IL-1β и IL-18. После активации IL-1β способствует проникновению иммунных клеток в инфицированные или поврежденные ткани, а IL-18 необходим для выработки интерферона-гамма, который стимулирует клетки иммунной системы. Также каспаза-1 запускает пироптоз. Для этого она расщепляет «белок смерти» газдермин D. Активированный газдермин D перфорирует клеточную мембрану, клетка разбухает и гибнет. Дестабилизация митохондрий, высвобождение мтДНК и кардиолипина являются важными факторами активации инфламмасомы.
Стареют не только клетки!
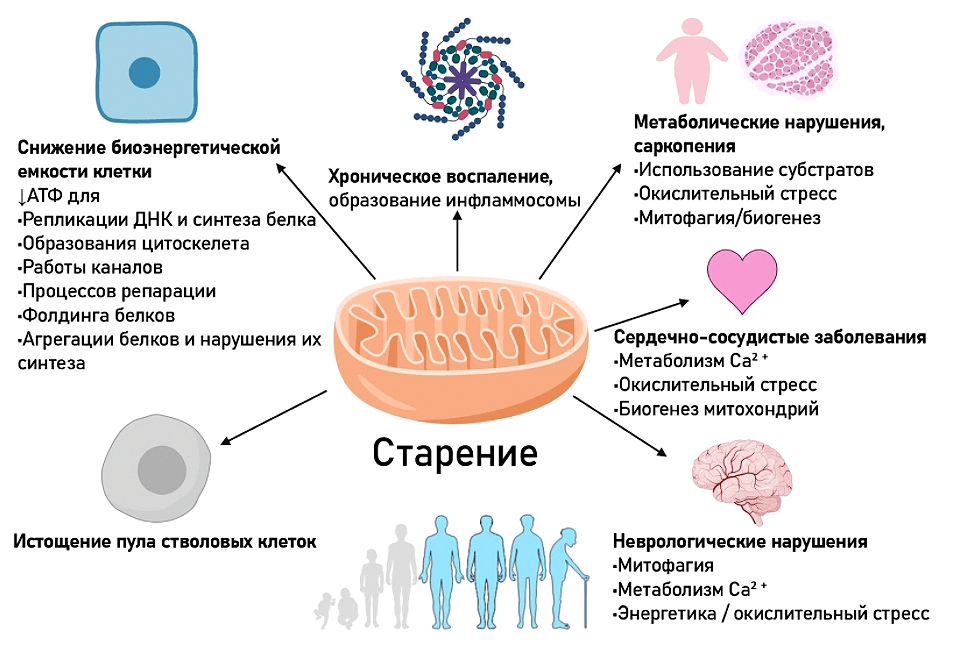
Рисунок 9. Роль митохондрий в старении клетки и организма
Видео 2. Почему возникают повреждения в митохондриях. Энергетика клеток, биоэнергетическая адаптация клеток и причины их нарушения. Митохондрии — клеточные сенсоры питательных веществ. Здоровая конкуренция субстратов в митохондриях — залог метаболического здоровья. Митохондрии стволовых и сенесцентных клеток, в чем их особенности. Роль митохондрий в стерильном воспалении и аутоиммунитете. Как связано старение организма и работа митохондрий.
- снижается общее их количество;
- происходит нарушение их внутренней структуры;
- снижается общее количество мтДНК;
- накапливаются различные повреждения мтДНК;
- нарушаются процессы контроля качества митохондрий — митофагии (удаления поврежденных митохондрий), биогенеза (образования митохондрий), динамики митохондрий.
Отчего же возникает митохондриальная дисфункция?
Существует предположение, что повышенное количество мутаций мтДНК влияет на старение и возрастные заболевания. Возражения скептиков сводятся к тому, что вряд ли они достигают такого уровня, чтобы ускорять старение, потому что мтДНК существует в сотнях тысяч копий на клетку. Для того чтобы клетка по-настоящему начала страдать от митохондриальной дисфункции, количество «поломанных» митохондрий должно преодолеть некую «пороговую черту» — около 60% всех митохондрий клетки должны стать нерабочими. Но любая ткань состоит из множества клеток! Сколько же митохондрий должно сломаться, чтобы действительно толкнуть процессы старения?