Биологи из Карлова университета в Праге (Чехия), под руководством
постодока Анны Карнковской (Anna Karnkowska), судя по всему,
обнаружили первый эукариотический (то есть имеющей в своих
клетках ядра) организм, лишенный митохондрий — органелл, служащих
клеткам «энергетической станцией». Статью об этом, опубликованную в журнале Current
Biology, пересказывает сайт журнала Science.
Уникальный организм, обнаруженный учеными — это одноклеточное
животное, жгутиконосец из рода Monocercomonoides.
Забавно, что чешские биологи выделили его из экскрементов
шиншиллы, живущей дома у одного из сотрудников лаборатории.
Поскольку жгутиконосец относился к группе микробов, по поводу
которой у ученых было подозрение, что у некоторых из ее
представителей нет митохондрий, Карнковская с коллегами решили
его проверить.
Расшифровав полный геном эукариота, авторы статьи не нашли в нем
никаких митохондриальных генов (которые, теоретически, должны
были быть, поскольку митохондрии обладают собственным ДНК). Более
того, углубленный анализ показал также, что у этого представителя
рода Monocercomonoides нет даже ни одного из ключевых
белков, которые позволяют митохондриям функционировать. Иначе
говоря, у него попросту нет митохондрий.
Как же этот жгутиконосец живет без «энергетических станций» в
своей клетке? Очень просто: в кишечнике грызуна, в котором он
обитает, в достатке питательных веществ, которые эукариот
расщепляет с помощью ферментов, содержащихся в его цитоплазме
(внутриклеточной жидкой среде). Зато в кишечнике шиншиллы нет
кислорода, без которого митохондрии все равно работать не могут.
Надо сказать, что митохондрии играют в клетках и еще одну важную
роль: они накапливают железо и серу, которые нужны для синтеза
многих важных белков. Однако Monocercomonoides и здесь
нашел альтернативное решение: похоже, он «позаимствовал»
некоторые гены бактерий, которые позволяют делать это без
митохондрий.
Похоже, что уникальный эукариот утратил митохондрии совсем
недавно (по меркам эволюции) — у его ближайших родственников эти
органеллы все же есть, хотя и уменьшенного размера.
«Это открытие фундаментальной важности, — сказал об открытии
коллег из Карлового университета эволюционный биолог Юджин Кунин
(Eugene Koonin) из Национального центра биотехнологической
информации в Бетесда, Мэриленд (США). — Теперь мы знаем, что
эукариоты могут отлично жить без митохондрий».
Эволюционный генетик Франц Ланг (B. Franz Lang) из Монреальского
университета (Канада) высказался более осторожно: «Результаты
этой работы выглядит очень солидно. Я бы сказал, вероятность
того, что они правы, составляет 90%».
Ранее одно время считалось, что митохондрий нет у
эукариотического микроба Giardia intestinalis,
вызывающего диарею. Однако потом выяснилось, что они у него
просто очень сильно редуцированы.
Открытие первого безмитохондриального эукариота заставляет
по-новому взглянуть на ранние этапы эволюции жизни на Земле. До
сих пор считалось, что наличие митохондрий — непременный признак
всех эукариот. Согласно господствующей сейчас теории, митохондрии
когда-то были самостоятельными бактериями, но потом наши
одноклеточные предки проглотили их и, вместо того, чтобы
переварить, поставили себе на службу. Или, согласно другой
версии, митохондрии сперва были паразитами, но потом подружились
с клеткой. Так или иначе, это объясняет, почему
у митохондрий до сих пор сохранилась собственная ДНК.
Напомним, недавно в России был создан
уникальный лекарственный препарат, предохраняющий митохондрии
клетки от повреждения агрессивными формами кислорода. А в
прошлом году мы опубликовали большую статью в двух частях, о
грядущих переменах в древе жизни — похоже, систематика будет
сильно меняться. См. «Эволюционное
древо: перезагрузка. Часть I» и, соответственно, «Эволюционное
древо: перезагрузка. Часть II».
В Главном здании МГУ имени М.В. Ломоносова состоялась лекция
доктора биологических наук, профессора Дмитрия Борисовича
Зорова «Митохондрии и болезни».
Митохондрия – это органоиды в клетках, являющиеся
источником энергии для этих клеток. Они считаются частью клетки и
отвечают за превращение органических веществ из пищи в энергию
для тела.
«Самое важное значение этой органеллы состоит в том, что она
вырабатывает аденозинтрифосфат (АТФ). Проще говоря, является
«электростанцией» в нашем организме, без нее клетки не могут
полноценно функционировать – постепенно «старятся» и погибают»,
– комментирует лектор.
В 1926 году Айвен Уоллин предположил, что митохондрии
когда-то были самостоятельно живущими бактериями, а в процессе
эволюции стали частью нашего организма. Даже находясь внутри
человеческой клетки, митохондрия продолжает оставаться
самостоятельной: у нее есть своя «кухня» по синтезу белка,
включая и собственные молекулы ДНК и РНК.
Сегодня снова перед научным миром встает вопрос, что
представляет собой митохондрия?
«Известно, что у митохондрии 1 500 собственных белков, и
каждый из них имеет определенную функцию. Так, только часть
белков отвечает за энергообразование, у другой же части белков –
иные задачи. Революция произошла в 1996 году, когда митохондрии
приписали новую роль – участие в клеточной гибели», –
объясняет Зоров.
Существует 14 разных видов гибели клеток. В этот момент
митохондрия «выпускает» из себя разные сигнальные вещества,
которые можно рассматривать, как инициаторов окончательного
процесса гибели клеток. Казалось бы, эта «убийственная»
функция нежелательна, не нужна организму, однако, это не так.
Ведь клетки в организме человека – разные, некоторых из них
делятся. Если отменить деление клеток – организму будет «плохо»,
если же запретить уничтожение клеток – в организме могут начать
развиваться фатальные процессы. Например, возникновение раковой
опухоли.
При нарушении работы этих незаметных нам «энергоблоков»
начинаются проблемы с энергообменом в клетке. При легких формах
нарушения человек не выдерживает простых физических нагрузок,
которые он способен переносить, исходя из своего возраста. Более
серьезные нарушения провоцируют необратимые изменения в
энергообмене, и как следствие, сильные нарушения в работе клеток.
«Для митохондрий не присуще рекомбинирование генов, но при
этом скорость мутации значительно выше. Во время деления
митохондрии распределение генов между новыми клетками имеет
совершенно случайный характер. Вероятность возникновения мутации
от 1 до 99%. Причем спрогнозировать ее нет никакой
возможности. И чем больше больных генов, тем больше
вероятность нарушения», – говорит Дмитрий Борисович.
Может ли человек сам влиять на работу митохондрий для
предотвращения «коллапсов»?
«На самом деле, мы можем достаточно легко увеличить
количество митохондрий в нашем организме и даже улучшить качество
их работы. К слову, сделать это помогают фитнес-тренировки.
Митохондрии не могут эффективно работать без кислорода. Именно
физические нагрузки способствуют увеличению количества
митохондрий и изменению их формы», – поясняет Зоров.
А что происходит в старости?
Когда основная масса митохондрий будет повреждена свободными
радикалами или их количество резко сократится, то они не смогут
производить достаточное количество энергии для поддержания жизни
– наступает старение мышечных волокон
человека. Это отражается на внутренних органах, которые
начинают чахнуть.
«Однако если митохондриям дать возможность эффективно
генерировать энергию, занимаясь физическими нагрузками аэробного
характера, поддерживая низкокалорийную диету, то старение
организма происходит не так стремительно», –
подытоживает ученый.
Биологи Иэн Джонстон (Iain Johnston) из университета Бирмингема и
Бен Уильямс (Ben Williams) из Кембриджского университета
выяснили, как митохондриям — органеллам и «энергетическим
станциям» живых клеток — удалось на протяжении сотен миллионов
лет эволюции сохранить собственную ДНК. Результаты их
исследования, подробно изложенные в журнале Cell
Systems, кратко пересказывает сайт журнала Science.
Чтобы исследовать, почему и зачем в митохондриях сохранились
остатки их ДНК, Джонстон и Уильмс проанализировали 2000
митохондриальных геномов самых разных существ, включая простейших
одноклеточных, животных, растения и грибы. На основании этого
анализа они реконструировали пути, по которым в разных ветвях
эволюционного древа живых организмов развивалась митохондриальная
ДНК.
Выяснилось, что в ней в основном сохранялись гены, кодирующие
синтез особых белков, вокруг которых в митохондрии формируются
белковые комплексы. Именно они играют ключевую роль в процессе
передачи электронов через мембрану митохондрии, благодаря
которому эти органеллы и способны вырабатывать энергию. «То, что
эти гены остаются непосредственно в митохондрии, дает клетке
возможность индивидуально контролировать ее работу», — объяснил
Джонстон.
Ну а кодирование других белков, не столь важных для выполнения
функции митохондрии, можно и «отдать на аутсорс» — в ДНК
клеточного ядра.
Ученые уже достаточно давно пришли к выводу, что митохондрии
когда-то были самостоятельными одноклеточными живыми существами.
Потом наши столь же одноклеточные предки проглотили их, но,
вместо того, чтобы переварить, поставили себе на службу,
«заставив» вырабатывать энергию. Таким образом, остатки
собственной ДНК — это своеобразный «рудимент» былой «свободы».
Большинство митохондриальных генов в процессе эволюции исчезли,
или мигрировали в геном ядра клетки. Сейчас, например, в
человеческих митохондриях всего 37 генов, а в ядре наших клеток,
для сравнения — свыше 20 000. Но почему это небольшое количество
генов все же сохранилось в митохондриях? Этот вопрос имеет отнюдь
не только теоретическое значение: мутации в митохондриальной ДНК
приводят к опасным наследственным заболеваниям.
Отметим, что анализ митохондриальной ДНК, которая передается по
женской линии, позволяет ученым пролить свет на многие темные
моменты в истории. Например,
определить личность Джека Потрошителя или доказать, что
сибирские и европейские неандертальцы были родственниками.
- Жизнь и смерть митохондрий
- «Как белка в колесе» — динамика митохондрий
- Здоровые циклы деления и слияния – залог метаболического здоровья клетки
- Митофузины – не просто какие-то белки
- Гипоталамус, митохондрии, метаболическая дисфункция и старение
- Так кто и как регулирует чувствительность нейронов гипоталамуса?
- Как повлиять на динамику митохондрий?
- Генная терапия митохондрий
- Перенос митохондрий
- Основные функции митохондрий
- Факторы, приводящие к повреждению митохондрий
Жизнь и смерть митохондрий
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
«Как белка в колесе» — динамика митохондрий
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
Так кто и как регулирует чувствительность нейронов гипоталамуса?
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Перенос митохондрий
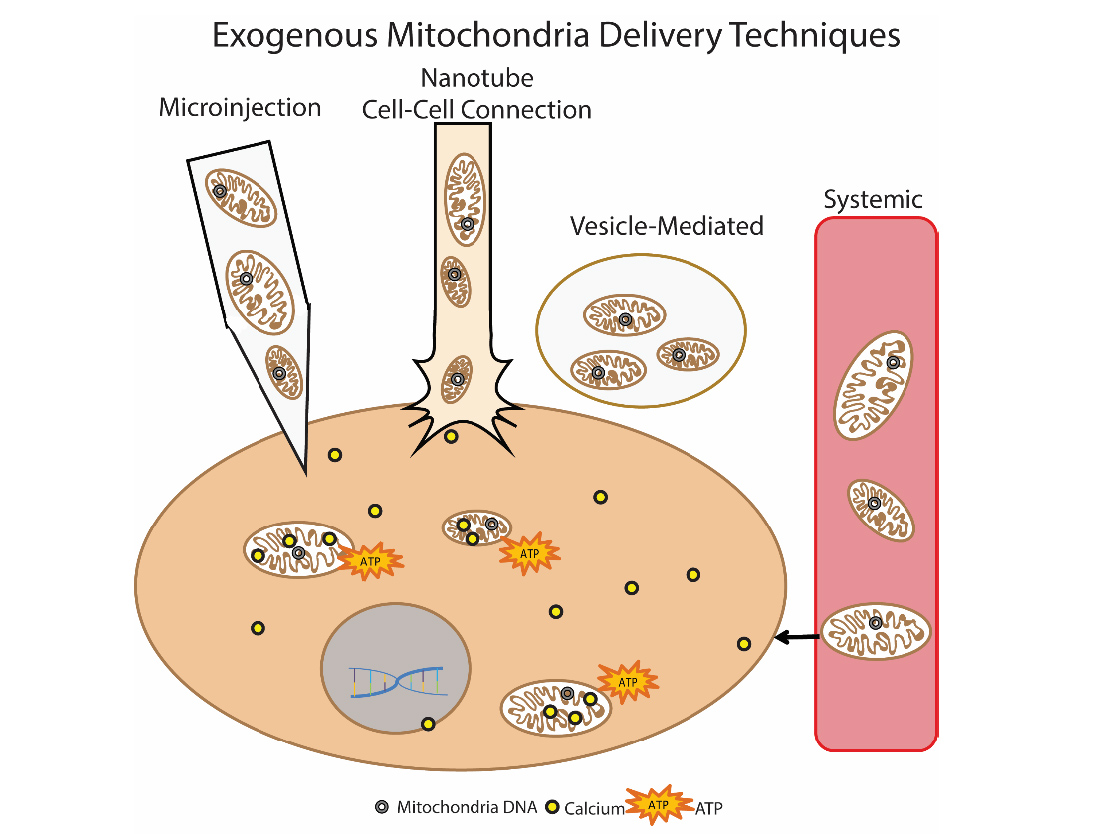
Рис.9 Способы доставки экзогенных митохондрий в клетку
Автор Ольга Борисова
1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S1550413116305022
2. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig1
3. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig3
4. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S0005272816300858
5. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full
6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs2
7. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S1550413116301176
8. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-6
9. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S0962892417301587
10. raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.10398
11. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-9
14. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223(17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053
Митохондрии представляют собой специализированные структуры в каждой клетке человеческого организма, кроме эритроцитов. Митохондрии содержат собственную ДНК. По сути, это небольшие, но мощные силовые клетки человека, которые служат батареями для питания различных функций вашего тела. Они отвечают за 90% клеточной энергии в форме аденозинтрифосфата (АТФ) и за поддержку метаболических функций. Митохондрии находятся в разных тканях по всему телу и, таким образом, по-разному служат разным целям этих конкретных тканей. Например, митохондрии в печени помогают превращать аммиак в менее токсичные отходы.
Основные функции митохондрий
Двумя основными функциями митохондрий являются клеточное дыхание и производство энергии. Эти две особенности являются основной причиной, почему вам нужно дышать и есть. Вашим митохондриям требуется как кислород из воздуха, так и глюкоза и жир из пищи для выработки энергии в форме АТФ.
Помимо производства энергии и клеточного дыхания, митохондрии играют роль в других функциях, включая гомеостаз кальция, рост клеток, деление клеток и гибель клеток. Они участвуют в поддержании функции нервной системы, в выработке тепла, являются основным клеточным органом для метаболических функций в цикле Кребса и других дыхательных циклах. Они находятся в синтезе биомолекул.
Проблемы, связанные с митохондриальной дисфункцией, могут возникнуть при рождении, но могут развиться в любом возрасте. Митохондриальные заболевания могут поражать любую клетку и любую часть тела, включая клетки сердца, почек, печени, поджелудочной железы, мышц, головного мозга, нервов, глаз или ушей. Различные состояния, включая болезнь Альцгеймера, диабет, мышечную дистрофию, могут привести к вторичному нарушению функций митохондрий.
Факторы, приводящие к повреждению митохондрий
Важно указать на спираль факторов, которые приводят к повреждению митохондрий. Начнем с неправильного питания, продолжаем хроническими стрессами, ослабляющими иммунную систему, а это приводит к повторным инфекциям разного рода с необходимостью давать антибиотики, что еще больше ослабляет иммунную систему. Токсины, которые воздействуют на вас как снаружи, так и изнутри. Недостаток качественного сна, здесь уместно было бы добавить восклицательный знак. Наконец, процессы, связанные со старением, и упор на так называемое преждевременное старение.
Эта спираль факторов приводит к сокращению производства энергии, а также к увеличению образования отходов. Эту ситуацию можно сравнить с некачественным топливом, которым вы топите печку дома. Окислительный стресс и горе увеличиваются, производство антиоксидантов снижается. Результатом описанных процессов является неэффективное производство энергии, плохой метаболизм жирных кислот, замедление метаболических реакций, повреждение белковых цепей и вновь усиление окислительного стресса.
И со временем эта спираль приводит к развитию хронического заболевания, как бы болезнь ни называлась. К ним относятся мигрени, сердечно-сосудистые заболевания, синдром хронической усталости, фибромиалгия, метаболический синдром, болезни Альцгеймера и Паркинсона, аутоиммунные заболевания, аутизм. Какова стратегия исправления? Всем ясно, что это не является приоритетом в приеме каких-либо лекарств. Символично, что стратегия должна начать переворачивать спираль вверх дном.
Каждый должен составить план питания, богатый питательными веществами, регулярно заниматься спортом, программировать снижение стресса, создавать условия для улучшения сна, включать голодание и использовать основные питательные вещества, которые, как мы знаем, поддерживают функцию митохондрий: альфа-липоевая кислота, омега-3 ЭПК, глюкозамин, креатин, кверцетин, зеленый чай (эпикатехин), L-карнитин и, наконец, коэнзим Q10.
Митохондрии – это электростанции, производящие необходимую для организма энергию, при этом для работы электростанции требуется качественное топливо. Его нельзя обмануть.

