Митохондрии
-двухмембранные
органеллы эукариотических клеток,
обладающие собственной ДНК(испыт
повреждения, тк нах в матриксе где много
биоокислителей-митохондриальн.болезни)
и выполняющие функцию синтеза
АTФ.Митохондрии
расположены около мест высокого
потребления АТФ(в скелетных мышцах –
вблизи миофибрилл. В сперматозоидах –
футляр вокруг оси жгутика. В аксонах
нервных кл-около синапсов, где происходит
процесс передачи нервного импульса)
Поток энергии обеспечивается механизмами
энергоснабжения —брожением, фото- или
хемосинтезом, дыханием. Центральная
роль в биоэнергетике клеток животных
принадлежит дыхательному обмену. Он
включает реакции расщепления глюкозы,
жирных кислот, аминокислот, а также
использование выделяемой энергии для
образования «топлива» в виде
аденозинтрифосфата (АТФ). Особое место
в дыхательном обмене принадлежит
митохондриям, выполняющим функцию
окислительного фосфорилирования.
Недоокисленные продукты гликолиза
(пируват) поступают в матрикс митохондрий,
где в условиях полного окисления,
сопряженного с фосфорилированием АДФ
до АТФ, отдают для нужд клетки оставшуюся
в их химических связях энергию.
Взаимосвязь внутриклеточного обмена
белков, жиров и углеводов обеспечивает
цикл Кребса.Ацетил-Коа
взаимод с оксалоацетатом=цитрат. Далее
в ходе 7-ми последовательных реакц 2
атома «С» удаляются в идее СО2, в конце
концов регенерируется оксалоацетат.
Высвобаждаются: 1АТФ и 1ФАДН2 с 3НАДН2,
кот используются в окислительном
фосфорилировании для синтеза АТФ путем
перекачки протонов и электоронов.
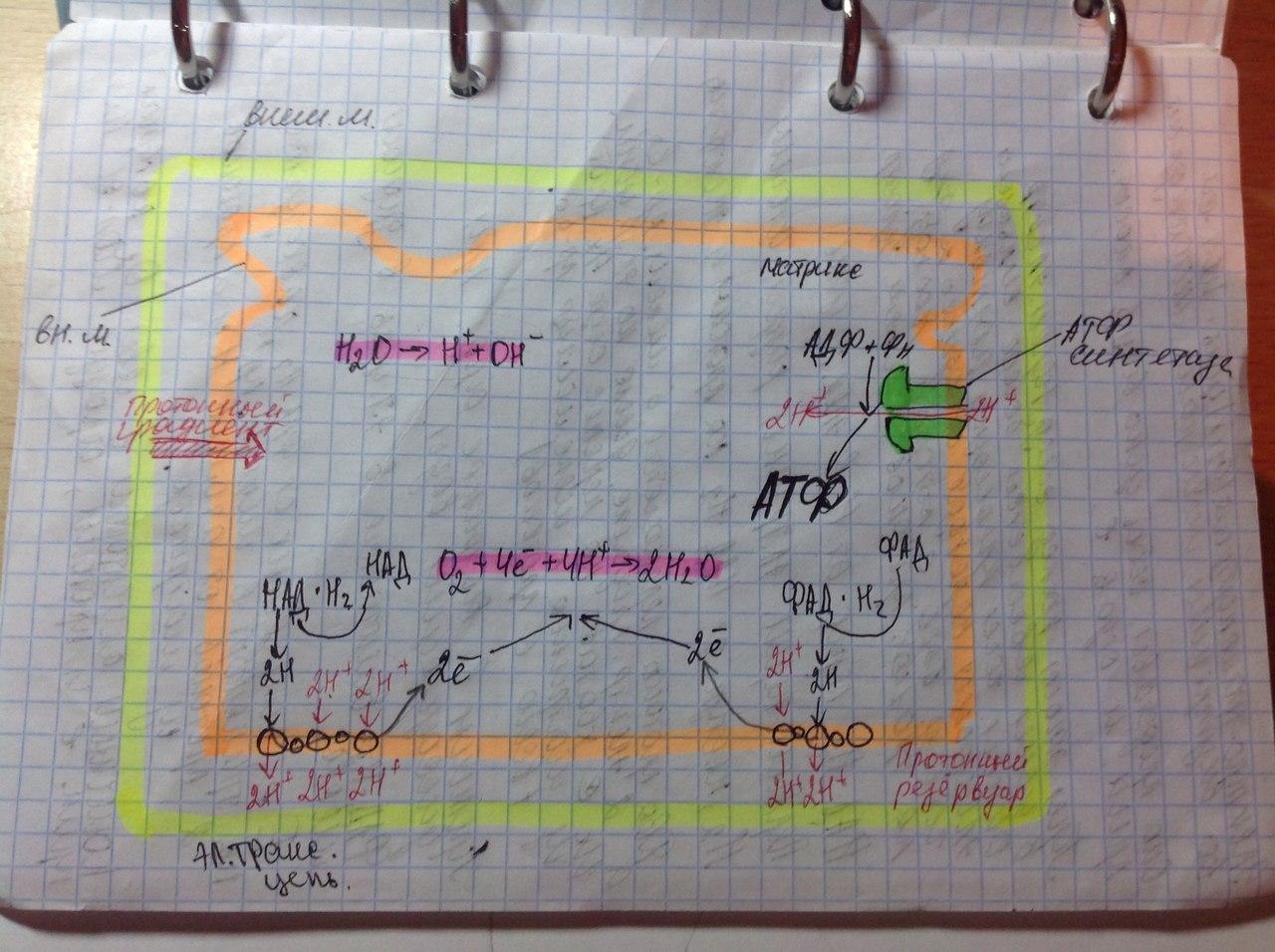
Окислительное
фосфорилирование-внутр мембр митохондрий,
где нах дых цепь(НАДН-дегидрогеназный
компл, компл цитохромов b-c1,цитохромоксидазный
компл) и комплекс АТФ-ситетазы. Электроны
перемещ от одного компл к другому,
достигая кислорода, имеющ наибольшее
сродство к электрону. Переход на более
низкие уровни сопровождается выделением
энергии, использ для перекачки протонов
в межмембранное пространство. Так
возникает протонный градиент(мембр
потенциал+градиент рН). При достижении
определ разности потенциалов, АТФ-синтетаза
начинает транспортировать протоны в
матрикс, превращая АДФ и неорганич
фосфат в энергию АТФ.
ИТОГ: 34+2+2=38
АТФ
Суть цикла:
Запасение энергии в виде
высокоэнергетическоемких электронов,
входящих в соста атомов водорода, связ
с НАД и ФАД, в электрон транспортную
сеть.
Суммарное уравнение может быть
записано в следующем виде:
Весь водород
из молекулы глюкозы оказывается в
конечном счете у переносчиков (НАД и
ФАД). Весь углерод теряется в виде С02.
- Митохондрии.
- Энергетический обмен, митохондрии
- Образование атф в митохондриях.
- Образование атф в клетке. Хемиосмотическая гипотеза Митчела.
- «Как белка в колесе» — динамика митохондрий
- Здоровые циклы деления и слияния – залог метаболического здоровья клетки
- Митофузины – не просто какие-то белки
- Гипоталамус, митохондрии, метаболическая дисфункция и старение
- Так кто и как регулирует чувствительность нейронов гипоталамуса?
- Как повлиять на динамику митохондрий?
- Генная терапия митохондрий
- Перенос митохондрий
Митохондрии.
Открыл в 1848 году,
Альтман.
Есть почти у всех
эукариотов. Это подвижные органоиды,
могут менять свою морфологию, объединяться,
разъединяться с помощью микротрубочек.
Различные по форме.
Период жизни
митохондрий короток. У человека они
живут 9 суток. Более 10 суток митохондрии
не живут, т.е., высокая степень обновления.
Основная функция
митохондрий – синтез
АТФ, дающий
энергию для всех жизненных процессов.
Митохондрии встречаются практически
у всех эукариотических клеток, кроме
двух видов паразитических амеб.
Митохондрии являются подвижными
пластичными органоидами, они могут
объединяться в гигантские структуры и
наоборот – разрушаться. Совокупность
всех митохондрий в клетке – хондриом.
Размеры варьируют от 1 до 10 мкм. Форма
чрезвычайно разнообразна. Но несмотря
на разнообразие форм и размеров, для
всех митохондрий характерен единый тип
строения. Митохондрия состоит из двух
мембран, наружной и внутренней, меж
которыми находится межмембранное
пространство, которое по сути является
протонным резервуаром. Внутри –
митохондриальный
матрикс.
Наружная мембрана
характеризуется большим количеством
транспортных белков. Эти белки имеют
специфическое название порины.
Они образуют широкие гидрофильные
каналы в бислое липидов, которые
пропускают молекулы с молекулярной
массой до 10000 Дальтон. На наружной
мембране имеются ферменты, которые
превращают липиды в реакционноспособные
соединения. Белков менее 20%. Из физических
свойств можно отметить, что наружная
мембрана может только необратимо
растягиваться.
Внутренняя мембрана
легко сморщивается и растягивается.
Она образует многочисленные складки,
которые называются кристы. Площадь
внутренней мембраны почти в
пять-семь раз больше,
чем наружной. Кристы бывают двух типов
– пластинчатые
в клетках многоклеточных животных и
растений; трубчатые
в тканях синтезирующих ферменты. Кристы
не статистические образования. Расположены
параллельно или перпендикулярно длинной
оси митохондрий.
Степень развития
крист, их количество определяется
функциональной значимостью клетки. На
внутренней мембране очень низок уровень
холестерина. Много особого фосфолипида
кардиолипида. Благодаря этому мембрана
имеет малую
проницаемость.
При суммарном подсчете и вычислении
соотношения белков и липидов получим,
что белков 75%, а липидов 25%.
- Грибовидные тельца
с АТФ-синтетазой; - Специфические
транспортные белки, регулирующие
перенос метаболитов в матрикс митохондрий
и из матрикса.
Межмембранное
пространство или протонный резервуар.
По химическому составу почти идентичен
цитозолю. Содержится только несколько
ферментов для обеспечения реакции
фосфорилирования.
Матрикс –
высококонцентрированная смесь, более
чем из ста компонентов, большинство из
которых – это ферменты цикла Кребса
(карбоновых кислот). Здесь же располагаются
кольцевые молекулы, митохондриальная
ДНК, тРНК, иРНК и митохондриальные
рибосомы с константой седиментации от
55 до 75S
Белки цепи
переноски электронов.
Это крупные ферментные комплексы, по
которым электроны опускаются на все
более низкие энергетические уровни.
Конечным акцептором является молекулярный
кислород. В цепи выделяют электрон-собирающие
и электрон-распределяющие участки и
последовательные ряды ферментов, с
которыми взаимодействуют электроны,
можно разделить на три главных
ферментативных комплекса:
- НАДН+-дегидрогеназный
комплекс. Состоит из двенадцати
полипептидных цепочек. Главные из этих
компонентов является НАДН+
и убихинон (ко Q). НАДН+-дегидрогеназа
первая принимает 2 протона и 2 электрона.
Убихинон –
небольшой переходный переносчик,
который тоже принимает и протоны и
электроны. Переносит протоны через
мембрану на наружную поверхность
сопрягающей мембраны. - Комплексу B=С
Этот комплекс состоит из 8 полипептидных
цепей. Содержит два цитохрома (В и С),
которые передают только электроны, а
протоны сбрасываются в межмембранное
пространство.
При этом, цитохром
С, принимающий электроны, передает их
на 3 комплекс.
Особую роль играют
Fe содержащие полипептиды. Они различаются
между собой в степени сродства к
электронам, которое выражается через
окислительно-восстановительный потенциал
молекулы. Чем выше этот потенциал, тем
больше сродство окисленной молекулы к
электрону. Электроны переходят по цепи
переноса. Их коферменты восстанавливаются
и окисляются. Цитохромидаза передает
электрон с комплекса цитохрома на
молекулярный кислород. Кислород
активируется и связывается с электронами.
Это важная реакция, в ней кислород
приобретает отрицательный заряд,
благодаря чему водород соединяется с
ним, и образуются вода.
Электроны
перемещаются в толще внутренней мембраны,
при этом через внутреннюю мембрану они
не проходят и остаются на внутренней
стороне мембраны. Протоны обратно не
возвращаются. Они остаются на внешнем
мембранном пространстве. На каждую
исходную молекулы C6H12O6
64 протона. В результате работы дыхательной
цепи на мембранах создается разных
электрических потенциалов. Внутренняя
сторона мембраны заряжается отрицательно
за счет скопления на ней электронов, а
наружная сторона внутренней мембраны
заряжается положительно.
Кроме того, поток
протонов создает между двумя сторонами
внутренней мембраны разность значения
рН. Таким образом, мы имеем кроме
мембранного потенциала еще и градиент
рН. Вместе они составляют электрохимический
протонный градиент. Величина
электрохимического протонного градиента,
который стимулирует синтез, равно 200
мВ. Заствляет ионы двигаться внутрь
матрикса. Заряд – источник протон-движущей
силы.
Грибовидное тело.
Белковый комплекс, который состоит из
двух основных частей: ножки (протон-движущий
канал) и головки (сопрягающего фактора).
Ножка находятся в толще внутренней
мембраны, имеет гидрофобную природу и
по сути является протон-проводящим
канал, по которому протоны из межмембранного
пространства возвращаются в матрикс
митохондрий
Головка тела
называется сопрягающий фактор. Здесь
располагается фермент АТФ-синтетаза,
который превращает энергию движения
протона в энергию органического синтеза,
синтезируя АТФ из молекулы АДФ и
неорганического фосфата (реакция
фосфорилирования).
АТФ занимает 15%
всех белков и образуется при прохождении
1-2 протонов.
Субстратами для
дыхания служат неорганические соединения.
Большинство клеток используют углеводы.
Вовлекаются в процесс расщепления
только после гидролиза до моносахаридов.
Крахмал гидрализуется в глюкозу. Гликоген
гидролизуется примерно до 30000 остатков
глюкоз. Ферментативное расщепление
этих запасных углеводов составляет
первый подготовительный этап
энергетического обмена. Вторым этапом
энергетического обмена является неполное
окисление глюкозы. Оно всегда
бескислородное. Всегда происходит
непосредственно в цитоплазме клетки и
называется гликолизом.
Гликолиз – неполное бескислородное
расщепление глюкозы или многоступенчатый
процесс по превращению углерода в 2
молекулы пировиноградной кислоты
(С3Н4О3).
В ходе гликолиза
выделяется большое количество энергии
(200 кДж на моль), 60% этой энергии рассеивается
в виде тепла, а 40% используется на синтез
АТФ. Кроме двух молекул пирувата,
образуются протоны, которые в цитоплазме
клетки запасаются в форме переносчика.
У животных преобладающим переносчиком
является НАДФ и соединяется с протоном.
Дальнейшая судьба
пирувата имеет три пути:
1) Характерный для
дрожжей и клеток растений при недостатке
кислорода происходит спиртовое брожение
и ПВК восстанавливается до этилового
спирта (С2Н5ОН).
2) В клетках животных
при недостатке кислорода. Накопление
в мышечных волокнах молочной кислоты.
Пируват восстанавливается до молочной
кислоты (С3Н6О3).
3) При наличии в
среде кислорода, продукты гликолиза
расщепляются до СО2
и Н2О
(полное окисление или клеточное дыхание).
Продукты гликолиза переходят для
дальнейшего расщепления в матрикс
митохондрий, где протекает третий этап
энергетического обмена – клеточное
дыхание. Пируват, одновременно с потоком
протонов, направляется внутрь митохондрий.
В матриксе молекулы пирувата взаимодействуют
с каталитическими белками и преобразуется
в молекулу ацетил-коА.
Только он
может вступить в цикл Кребса. Он
вовлекается в цикл трикарбоновых кислот,
который представляет собой цепь
последовательных реакций, в ходе которых
из одной молекулы ацетил-коА образуются
молекулы углекислого газа, 2 АТФ и 4 атома
водорода. Таким образом, в результате
бескислородного окисления и цикла
Кребса, одна молекула глюкозы расщепляется
до диоксида углерода, который легко
выходит из клетки через мембрану и
высвобождающееся при реакции энергия
расходуется в небольшом количестве на
синтез АТФ, а в основном запасается в
нагруженных электронами переносчиков.
Белки-переносчики транспортируют
протоны и электроны к внутренней мембране
митохондрий, где передают их на цепь
дыхательных ферментов.
Транспорт протонов
и электронов приводит к накоплению в
протонном резервуаре протонов. Наружная
поверхность внутренней мембраны заряжена
положительно. Электроны обеспечивают
отрицательный заряд внутренней стороны
мембраны. Когда разность потенциалов
= 200мВ, открывается канал в ножке
грибовидного тела, протоны проталкиваются
через ножку, отдавая энергию ферменты
АТФ-синтетазе, что обеспечивает реакцию
фосфорилирования.
Синтез АТФ сопряжен
с обратным потоком протонов в матрикс.
Протонный градиент
через внутреннюю мембрану митохондрий
дает примерно 24 кДЖ на моль переносимых
протонов. И процесс переноса электронов
(окисление) в мембранах связан с
образованием АТФ из АДФ (реакция
фосфорилирования) и поэтому весь
называется окислительное фосфорилирования.
Ведущую роль в
этих реакциях выполняет внутренняя
сопрягающая мембрана митохондрий. В
процессе окислительного фосфорилирования
перенос каждой пары электронов с
переносчика на молекулярный кислород
доставляет энергию примерно для
образования трех молекул АТФ. При
окислении одной молекулы глюкозы
образуется в реакциях третьего этапа
36 молекул АТФ. Две молекулы АТФ образуются
в бескислородном втором этапе обмена
и поэтому общий выход = 38 молекул АТФ на
одну полностью окисленную молекулу
глюкозы. 55% энергии запасается в виде
химических связей, 45% энергии рассеивается
в виде теплоты.
Сопряжение окисления
и фосфорилирование известно как
хемиосмотическая гипотеза Митчела.
В1978 году он был лауреатом нобелевской
премии за исследование процесса переноса
энергии в клетках и разработку
хемиосмотической теории. Эта теория
объясняет механизм преобразования
энергии в биологической мембране при
синтезе АТФ.
Обмен веществ
между цитоплазмой и матриксом
обеспечивается специальными транспортными
системами, локализованными во внутренней
мембране митохондрии и обеспечивающие
перенос веществ разными механизмами
активного транспорта.
1) По механизма
типа антипорт, когда два вещества
переносятся одновременно в противоположных
направлениях. Большая часть АТФ,
продуцированная митохондриями, выходит
в цитоплазму. Этот перенос осуществляется
АТФ-АДФтранслоказой
2) Симпорт или
сопряженный транспорт. Таким образом,
при участии специфического переносчика
осуществляется одновременный перенос
пирувата и ионов фосфата и протонов.
3) Унипорт. Облегченная
диффузия. Только одно вещество переносится
через мембрану в одном направлении
(ионы кальция внутрь матрикса). С помощью
транспортных белков.
Митохондрия –
полуавтономный органоид. Митохондрии
увеличиваются в количестве при делении
клеток (особенно в период G2),
при увеличении функциональной активности
и нагрузки клетки. Увеличение их
количества происходит путем роста и
деления материнских митохондрий. Делятся
митохондрии путем перетяжки, или
отпочковывания, или возникновения
дочерних митохондрий внутри материнских.
В матриксе
митохондрий содержится собственная
генетическая система, необходимая для
процессов воспроизведения. Это
митохондриальная ДНК, митохондриальные
рибосомы. Гистонов нет. Эти структуры
были обнаружены в 1963 году Нассом.
Митохондриальная ДНК имеет кольцевую
природу. Известно, что все митохондрии
содержат несколько копий своего генома.
От одной копии до десяти. Линейная длина
молекулы варьирует от 5 до 30 мкм. Из
нуклеотидных оснований преимущественно
гуанин и цитозин.
Рибосомы вариабельны,
с константой седиментации 55 – 75S. В 1981
году была расшифрована нуклеотидная
последовательность митохондриального
генома человека. Было показано, что в
митохондриях человека содержится 2 гена
рРНК, 22 гена тРНК и 13 генов, которые
кодируют белки. Репликация и транскрипция
происходят в матриксе митохондрий, и в
этих процессах преобладает контроль
со стороны ядерного генома. Делению или
репродукции митохондрий обязательно
предшествует репликация митохондриальной
ДНК. И этот процесс происходит независимо
от репликации ядерной ДНК. Но обычно
тогда, когда уже ядерная ДНК вся
реплицировалась.
Происхождение и
эволюцию митохондрий объясняют с позиции
эндосимбиотической
гипотезы. И
эта же самая гипотеза представляет
современные митохондрии прямыми
потомками бактериального симбионта.
Это особая группа фотосинтезирующих
бактерий, которые утратили, внедрившись
в организм хозяина, способность к
фотосинтезу, но сохранили дыхательную
функцию. Эти пурпурные бактерии,
внедрившись в другую эукариотическую
клетку, укоренились к ней.
Последние наблюдения
цитологов после расшифровки генома
показали, что митохондрии эволюционировали
вместе со всеми эукариотами от одного
общего предка (коэволюция – совместная
эволюция). Эволюционно, митохондриальный
и ядерные
компоненты
эукариот возникли одновременно.
Энергетический обмен, митохондрии
Каждая клетка –
сложная высокоупорядоченная система
и содержимое клетки находится в состоянии
непрерывного активного метаболизма.
Реакции в клетке
подразделяют на две группы:
1) Реакции синтеза
крупных молекулярных структур, которые
протекают с затратой энергии, называются
реакциями синтеза, ассимиляцией или
анаболизмом.
2) Реакции распада
крупных молекул на более мелкие и
простые, протекающие обычно с высвобождением
энергии. Реакции диссимиляции или
катаболизма.
Реакции ассимиляции
формируют так называемый пластический
тип метаболизма. А реакции диссимиляции
– это реакции энергетического обмена.
Все реакции
пластического и энергетического обмена
можно назвать метаболизмом.
Поступающие в
клетку вещества служат строительным
материалом для биосинтеза клеточных
структур и компонентов клетки, а
во-вторых, эти же вещества являются
источником химической энергии.
У всех эукариотических
клеток можно выделить три типа органоидов
энергетического обмена. В растительных
клетках это тилакоидные мембраны
пластиды,
в животных – внутренние мембраны
митохондрий,
а у аэробных бактерий – сопрягающие
мембраны.
На самом деле, пластиды и митохондрии
имеют сопрягающую мембрану.
Для всех сопрягающих
мембран характерны особенности, которые
отличают эту мембрану от других мембран
эукариотических клеток:
1) Сопрягающие
мембраны способны синтезировать
АТФ за счет
внешних ресурсов.
2) Сопрягающие
мембраны несут цепь
переноса электронов.
3) Сопряженные
мембраны имеют специальные «грибовидные»
тельца, в которых находится фермент,
обеспечивающий синтез молекул АТФ с
названием АТФ-синтетаза.
4) Во всех сопрягающих
мембранах содержится повышенная
концентрация белков и низкая концентрация
холестерина.
Преобладающим
фосфолипидом в этих мембранах является
кардиолипин, наличие которого обуславливает
крайне низкую
избирательную способность.
Основой для
связывания двух биохимических процессов,
протекающих на сопрягающей мембране
является мембранный потенциал, который
создается на сопрягающей мембране.
Митохондрии
– это структуры палочковидной или
овальной формы (греч. mitos
–
нить,
chondros
– гранула). Они обнаружены во всех животных
клетках (исключая зрелые эритроциты):
у высших растений, у водорослей и
простейших. Отсутствуют они только у
прокариот бактерий.
Эти
органеллы впервые были обнаружены и
описаны в конце прошлого столетия
Альтманом. Несколько позже эти структуры
были названы митохондриями. В 1948 г.
Хогебум указал на значение митохондрий
как центра клеточного дыхания, а в 1949
г. Кеннеди и Ленинджер установили, что
в митохондриях протекает цикл
окислительного фосфорилирования. Так
было доказано, что митохондрии служат
местом генерирования энергии.
Митохондрии видны
в обычном световом микроскопе при
специальных методах окраски. В фазово
– контрастном микроскопе и в «темном
поле» их можно наблюдать в живых клетках.
Строение,
размеры, форма
митохондрий очень вариабельны. Это
зависит в первую очередь от функционального
состояния клеток. Например, установлено,
что в мотонейронах мух, летающих
непрерывно 2 часа, проявляется огромное
количество шаровидных митохондрий, а
у мух со склеенными крыльями число
митохондрий значительно меньше и они
имеют палочковидную форму (Л. Б. Левинсон).
По форме они могут быть нитевидными,
палочковидными, округлыми и гантелеобразными
даже в пределах одной клетки.
Митохондрии
локализованы в клетке, как правило, либо
в тех участках, где расходуется энергия,
либо около скоплений субстрата (например,
липидных капель), если таковые имеются.
Строгая ориентация
митохондрий обнаруживается вдоль
жгутиков сперматозоидов, в поперечно-полосатой
мышечной ткани, где они располагаются
вдоль миофибрилл, в эпителии почечных
канальцев локализуются во впячиваниях
базальной мембраны и т.д.
Количество
митохондрий в клетках имеет органные
особенности, например, в клетках печени
крыс содержится от 100 до 2500 митохондрий,
а в клетках собирательных канальцев
почки – 300, в сперматозоидах различных
видов животных от 20 до 72, у гигантской
амебы Chaos
chaos
их число достигает
500 000. Размеры митохондрий колеблются
от 1 до 10 мкм.
Ультрамикроскопическое
строение митохондрий однотипно,
независимо
от их формы и размера. Они покрыты двумя
липопротеидными мембранами: наружной
и внутренней. Между ними располагается
межмембранное пространство.
Впячивания
внутренней мембраны, которые вдаются
в тело митохондрий, называются кристами.
Расположение крист в митохондриях может
быть поперечным и продольным. По форме
кристы могут быть простыми и разветвленными.
Иногда они образует сложную сеть. В
некоторых клетках, например, в клетках
клубочковой зоны надпочечника кристы
имеют вид трубочек. Количество крист
прямо пропорционально интенсивности
окислительных процессов, протекающих
в митохондриях. Например, в митохондриях
кардиомиоцитов их в несколько раз
больше, чем в митохондриях гепацитов.
Пространство, ограниченное внутренней
мембраной, составляет внутреннюю камеру
митохондрий. В нем между кристами
находится митохондриальный матрикс —
относительно электронно плотное
вещество.
Белки внутренней
мембраны синтезируются миторибосомами,
а белки внешней мембраны – циторибосомами.
‘Наружная мембрана
митохондрий по многим показателям
сходна с мембранами ЭПС. Она бедна
окислительными ферментами. Немного их
и в мембранном пространстве. Зато
внутренняя мембрана и митохондриальный
матрикс буквально насыщены ими. Так, в
матриксе митохондрий сосредоточены
ферменты цикла Кребса и окисления жирных
кислот. Во внутренней мембране локализована
цепь переноса электронов, ферменты
фосфорилирования (образования АТФ из
АДФ), многочисленные транспортные
системы.
Кроме белка и
липидов, в состав мембран митохондрий
входит РНК, ДНК, последняя обладает
генетической специфичностью, и по своим
физико-химическим свойствам отличается
от ядерной ДНК.
При
электронно-микроскопических исследованиях
обнаружено, что поверхность наружной
мембраны покрыта мелкими шаровидными
элементарными частицами. Внутренняя
мембрана и кристы содержат подобные
элементарные частицы на «ножках», так
называемые грибовидные тельца. Они
-состоят из трех частей: головки
сферической формы (диаметр 90-100 А°), ножки
цилиндрической формы, длиной 5 нм и
шириной 3-4 нм, основания, имеющего размеры
4 на 11 нм. Головки грибовидных телец
связаны с фосфорилированием, затем
обнаружено, что головки содержат фермент,
обладающий АТФ-идной активностью.
В межмембранном
пространстве находится вещество,
обладающее более низкой электронной
плотностью, чем матрикс. Оно обеспечивает
сообщение между мембранами и поставляет
для ферментов, находящихся в обеих
мембранах, вспомогательные
катализаторы-коферменты.
В
настоящее время известно, что наружная
мембрана митохондрий хорошо проницаема
для веществ, имеющих низкий молекулярный
вес, в частности, белковых соединений.
Внутренняя мембрана митохондрий обладает
избирательной проницаемостью. Она
практически непроницаема для анионов
(Cl-1,
Br-1,
SO4-2,
HCO3-1,
катионов Sn+2,
Mg+2,
ряда cахаров
и большинства аминокислот, тогда как
Са2+,
Мп2+,
фосфат, многокарбоновые
кислоты
легко проникают через нее. Имеются
данные о наличии во внутренней мембране
нескольких переносчиков, специфических
к отдельным группам проникающих анионов
и катионов. Активный транспорт веществ
через мембраны осуществляется благодаря
использованию энергии АТФ-азной системы
или электрического потенциала,
генерируемого на мембране в результате
работы дыхательной цепи. Даже АТФ,
синтезированная в митохондриях, может
выйти с помощью переносчика (сопряженный
транспорт).
Матрикс
митохондрий представлен мелкозернистым
электронно-плотным веществом. В нем
располагаются миторибосомы, фибриллярные
структуры, состоящие из молекул ДНК и
гранул, имеющих диаметр более 200А◦
образованные
солями: Ca3(PO4),
Ba3(PO4)2,
Mg3(PO4).
Полагают, что гранулы служат резервуаром
ионов Са+2
и Мg+2.
Их количество увеличивается при изменении
проницаемости митохондриальных мембран.
Присутствие
в митохондриях ДНК обеспечивает участие
митохондрий в синтезе РНК и
специфических
белков, а также указывает на существование
цитоплазматической наследственности.
Каждая митохондрия содержит в зависимости
от размера одну или несколько молекул
ДНК (от 2 до 10). Молекулярный вес
митохондриальной ДНК около (30-40)*106
у простейших, дрожжей, грибов. У высших
животных около (9–10) *106.
Длина
ее у дрожжей примерно равна 5 мкм, у
растений – 30 мкм. Объем генетической
информации, заключенный в митохондриальной
ДНК, невелик: он состоит из 15-75 тыс. пар
оснований, которые могут кодировать в
среднем 25-125 белковых цепей с молекулярным
весом около 40000.
Митохондриальная
ДНК
отличается
от ядерной ДНК
рядом особенностей:
более высокой скоростью синтеза (в 5-7
раз), она более устойчива к действию
ДНК-азы, представляет собой двухкольцевую
молекулу, содержит больше гуанина и
цитозина, денатурируется при более
высокой температуре и легче
восстанавливается. Однако не все
митохондриальные белки синтезируются
митохондриальной
системой. Так, синтез цитохрома С и
других
ферментов
обеспечивается информацией, содержащейся
в ядре. В матриксе митохондрий локализованы,
витамины А, В2,
В12,
К, Е,
а
также гликоген.
Функция
митохондрий
заключается
в образовании энергии, необходимой для
жизнедеятельности клеток. Источником
энергии в клетке могут служить различные
соединения: белки, жиры, углеводы. Однако
единственным субстратом, который
немедленно включается в энергетические
процессы, является глюкоза.
Биологические
процессы, в результате которых в
митохондриях образуется энергия, можно
подразделить на 3 группы: I
группа – окислительные реакции, включающие
две фазы: анаэробную (гликолиз) и аэробную.
II
группа – дефосфорилирование, расщепление
АТФ и высвобождение энергии. III
группа – фосфорилирование, сопряженное
с процессом окисления.
Процесс окисления
глюкозы вначале происходит без участия
кислорода (анаэробным или гликолитическим
путем) до пировиноградной или молочной
кислоты.
Однако при этом
энергии выделяется лишь небольшое
количество. В дальнейшем эти кислоты
вовлекаются в процессы окисления,
которые протекают с участием кислорода,
т. е. являются аэробными. В результате
процесса окисления пировиноградной и
молочной кислоты, названной циклом
Кребса, образуется углекислый газ, вода
и большое количество энергии.
Образующаяся
энергия не выделяется в виде тепла, что
привело бы к перегреванию клеток и
гибели всего организма, а аккумулируется
в удобной для хранения и транспорта
форме в виде аденозинтрифосфорной
кислоты (АТФ). Синтез АТФ происходит из
АДФ и фосфорной кислоты и вследствие
этого называется фосфорилированием.
В здоровых клетках
фосфорилирование сопряжено с окислением.
При заболеваниях сопряженность может
разобщаться, поэтому субстрат окисляется,
а фосфорилирование не происходит, и
окисление переходит в тепло, а содержание
АТФ в клетках снижается. В результате
повышается температура и падает
функциональная активность клеток.
Итак,
основная функция митохондрий
заключается
в выработке практически
всей энергии клетки и происходит синтез
компонентов, необходимых для деятельности
самого органоида, ферментов «дыхательного
ансамбля», фосфолипидов и белков.
Еще одной стороной
деятельности митохондрий является их
участие в специфических синтезах,
например, в синтезе стероидных гормонов
и отдельных липидов. В ооцитах разных
животных образуются скопления желтка
в митохондриях, при этом они утрачивают
свою основную систему. Отработавшие
митохондрии могут накапливать также
продукты экскреции.
В
некоторых
случаях (печень, почки) митохондрии
способны аккумулировать вредные вещества
и яды, попадающие в клетку, изолируя их
от основной цитоплазмы и частично
блокируя вредное действие этих веществ.
Таким образом, митохондрии способны
брать на себя функции других органоидов
клетки, когда это требуется для
полноценного обеспечения того или иного
процесса в норме или в экстремальных
условиях.
Биогенез
митохондрий.
Митохондрии
представляют собой обновляющиеся
структуры с довольно кратким жизненным
циклом (в клетках печени крысы, например,
период полужизни митохондрий охватывает
около 10 дней). Митохондрии образуются
в результате роста и деления предшествующих
митохондрий. Деление их может происходить
тремя способами: перетяжкой, отпочковыванием
небольших участков и возникновением
дочерних митохондрий внутри материнской.
Делению (репродукции) митохондрий
предшествует репродукция собственной
генетической системы – митохондриальной
ДНК.
Итак,
согласно взглядам большинства
исследователей, образование митохондрий
происходит преимущественно путем
саморепродукции их de
novo.
Образование атф в митохондриях.
См. 31 вопрос
Образование атф в клетке. Хемиосмотическая гипотеза Митчела.
Для образования АТФ ферментная система
АТФ-синтетаза использует разницу
электрохимических потенциалов и
концентрации ионов водорода на разных
сторонах мембраны, перераспределяя
поток водорода: с внешней мембраны
переносит ионы водорода на внутреннюю.
Во время перенесения электронов от НАДН
к кислороду выделяется энергия,
необходимая для синтеза трех молекул
АТФ.
Соседние файлы в предмете Биология
Время на прочтение
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
«Как белка в колесе» — динамика митохондрий
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
Так кто и как регулирует чувствительность нейронов гипоталамуса?
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Перенос митохондрий
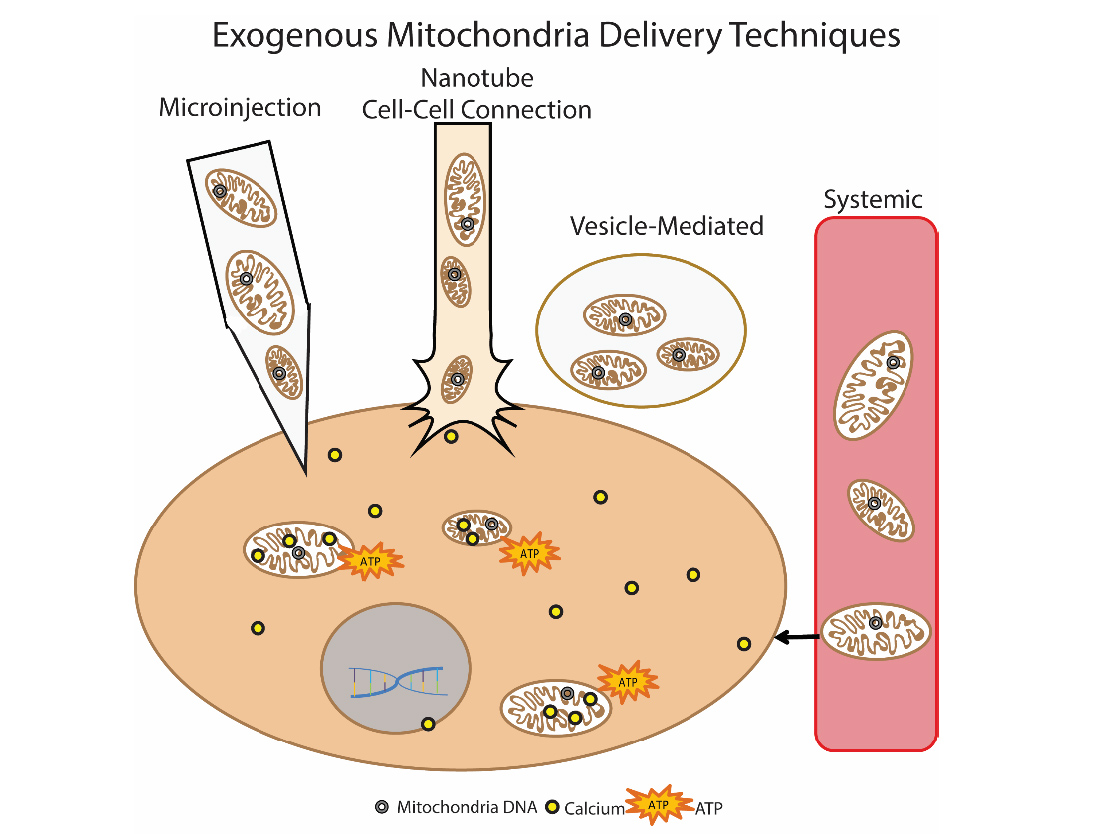
Рис.9 Способы доставки экзогенных митохондрий в клетку
Автор Ольга Борисова
1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S1550413116305022
2. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig1
3. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig3
4. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S0005272816300858
5. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full
6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs2
7. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S1550413116301176
8. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-6
9. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S0962892417301587
10. raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.10398
11. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-9
14. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223(17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053








