О2
переносится к тканям в двух формах:
связанный с гемоглобином и растворенный
в плазме.
В
крови содержится лишь незначительное
количество О2,
растворимого в плазме. Согласно закону
Генри, количество газа, растворенного
в жидкости, прямо пропорционально
его парциальному давлению и коэффициенту
растворимости. Растворимость О2
в плазме крови низка: при РО2
= 1 мм рт.ст. в 100 мл крови растворяется
0,0031 мл О2.
Растворенный
О2
= РаО2
х 0,0031 мл О2/100
мл крови/мм рт.ст.
Положение
кривой диссоциации оксигемоглобина
зависит от сродства гемоглобина с
кислородом. При снижении сродства
гемоглобина к О2, т.е. облегчении перехода
О2 в ткани, кривая сдвигается вправо.
Повышение сродства гемоглобина к О2
означает меньшее высвобождение кислорода
в тканях, при этом кривая диссоциации
сдвигается влево. Важным показателем,
отражающем сдвиги кривой диссоциации
оксигемоглобина, является параметр
р50,
т.е.
такое РО2, при котором гемоглобин насыщен
кислородом на 50 %. В нормальных условиях
у человека (при t 37 °С, рН 7,40 и РаСО2 = 40 мм
рт.ст.) р50
=
27 мм рт.ст. При сдвиге кривой диссоциации
вправо P50
увеличивается, а при сдвиге влево —
снижается.
На
сродство гемоглобина к О2 оказывают
влияние большое количество метаболических
факторов, к числу которых относятся рН,
РСО2, температура, концентрация в
эритроцитах 2,3-дифосфоглицерата
(2,3-ДФГ). Снижение рН, повышение РСO2 и
температуры снижают сродство гемоглобина
к О2 и смещению кривой вправо. Такие
метаболические условия создаются в
работающих мышцах, и такой сдвиг кривой
является физиологически выгодным,
так как повышенное высвобождение О2
необходимо для активной мышечной работы.
Влияние рН и РаСО2 на кривую диссоциации
называется эффектом Бора. На кривую
диссоциации оксигемоглобина может
оказать влияние и окись углерода (СО).
СО имеет сродство к гемоглобину в 240 раз
выше, чем О2, и, связываясь с гемоглобином,
образует карбоксигемоглобин (НbСО). При
этом даже небольшие количества СО могут
связать большую часть НЬ крови и
значительно уменьшить содержание О2
крови. Кроме того, СО сдвигает кривую
диссоциации влево, что препятствует
высвобождению О2 в тканях и также
усугубляет гипоксию.
Еще
одним фактором, влияющим на сродство
Нb к кислороду, является метгемоглобин
— гемоглобин, содержащий железо,
окисленное до Fе3+.
У здорового человека общее содержание
метгемоглобина не превышает 3 %, однако
при приеме некоторых лекарств (например,
фенацетин, сульфаниламиды, нитроглицерин)
и дефиците фермента метгемоглобин-редуктазы
происходит образование значительных
количеств метгемоглобина. Метгемоглобинемия
вызывает смещение кривой диссоциации
влево, т.е препятствует высвобождению
в тканях, а при повышении концентрации
метгемоглобина более 60 % происходит
также и уменьшение нормального Нb,
что приводит к тяжелой гипоксии.
10.
газообмен и транспорт диоксида углерода
(СО) кровью. Особенность диффузии СО
через аэрогематический барьер, коэффициент
растворимости, величина концентрационного
градиента. Роль карбоангидразы. Механизмы
транспорта СО и их количественная
хар-ка. Углекислый
газ является конечным продуктом
клеточного метаболизма. СО2 образуется
в тканях, диффундирует в кровь и
переносится кровью к легким в трех
формах: растворенной в плазме, в составе
бикарбоната и в виде карбаминовых
соединений эритроцитов.
Количество
СО2, растворимого в плазме, как и для О2,
определяется законом Генри, однако
его растворимость в 20 раз выше, поэтому
количество растворенного СО2 довольно
значительно и составляет до 5—10 % от
общего количества СО2 крови.
Реакция
образования бикарбоната описывается
следующей формулой:
Первая
реакция протекает медленно в плазме и
быстро — в эритроцитах, что связано с
содержанием в клетках фермента
карбоангидразы. Вторая реакция —
диссоциация угольной кислоты — протекает
быстро, без -участия ферментов. При
повышении в эритроците ионов НСО3
происходит их диффузия в кровь через
клеточную мембрану, в то время как для
ионов Н+
мембрана
эритроцита относительно непроницаема
и они остаются внутри клетки. Поэтому
для обеспечения электронейтральности
клетки в нее из плазмы входят ионы Сl-
(так называемый хлоридный сдвиг)
Высвобождающиеся
ионы Н+
связываются с гемоглобином:
Восстановленный
гемоглобин является более слабой
кислотой, чем ок-сигемоглобин. Таким
образом, наличие восстановленного Нb в
венозной крови способствует связыванию
СО2, тогда как окисление НЬ в сосудах
легких облегчает его высвобождение.
Такое повышение сродства СО2 к гемоглобину
называется эффектом Холдейна. На долю
бикарбоната приходится до 90 % всего
СО2, транспортируемого кровью.
Карбаминовые
соединения образуются в результате
связывания СО2 с концевыми группами
аминокислот белков крови, важнейшим из
которых является гемоглобин (его
глобиновая часть):
В
ходе этой реакции образуется
карбаминогемоглобин. Реакция протекает
быстро и не требует участия ферментов.
Как и в случае с ионами Н+,
восстановленный Нb обладает большим
сродством к СО2,
чем оксигемоглобин. Поэтому
деоксигенированный гемоглобин облегчает
связывание СО2
в тканях, а соединение Нb с О2
способствует высвобождению СО2.
В виде карбаминовых соединений содержится
до 5 % общего количества СО2
крови.
Дыхательный
пигмент, содержащийся в эритроцитах, с
помощью которого осуществляется
транспорт молекулярного кислорода из
легких к тканям. Относится к сложным
белкам – хромопротеидам. Молекула
гемоглобина состоит из двух частей:
простетической группы (гема), в состав
которой входит атом железа, и белка типа
альбуминов – глобина. На долю гема
приходится 4 % молекулы гемоглобина, а
глобина – 96 %. Гем относится к порфиринам,
он содержит 4 пирроловые группы,
соединенные в центре атомом железа. При
потере железа гем превращается в
гематопорфирин. Как в оксигемоглобине,
так и в редуцированном гемоглобине
железо находится в двухвалентной
закисной форме. Трехвалентная (окисная)
форма железа, не способная переносить
молекулярный кислород, может образовываться
при окислении в метгемоглобин. При
разрушении эритроцитов (гемоглобина)
в конечном счете в печени образуются
желчные пигменты – билирубин и биливердин;
в течение суток 3,6 г гемоглобина
превращается в желчные пигменты.
В
капиллярах легких гемоглобин (гем)
вступает с кислородом в непрочное
соединение, образуя оксигемоглобин, а
в капиллярах тканей происходит отщепление
кислорода и восстановление гемоглобина.
Последний вновь легко вступает в
соединение с кислородом. Нарушение
дыхательной функции крови может
наблюдаться при уменьшении количества
гемоглобина, эритроцитов в крови (анемии)
и изменении качества гемоглобина:
образовании карбоксигемоглобина
(отравлении окисью углерода), метгемоглобина
(отравлении гемолитическими ядами)
сульфгемоглобина.
С
помощью физико-химических методов
исследования (электрофорез, хроматография)
удалось установить неоднородность
человеческого гемоглобина, существование
различных его типов как в нормальных,
так и в патологических условиях. В
настоящее время известны три формы
нормального гемоглобина:
Примитивный
гемоглобин (гемоглобин Р)
Это
гемоглобин, который может быть обнаружен
у трехсантиметрового зародыша,
характеризуется высокой щелочной
резистентностью и малой электрофоретической
подвижностью. Находится в эритроцитах
зародыша до 18 – недельного возраста (в
основном между 7 – й и 12 – й неделями),
затем сменяется фетальным гемоглобином.
Фетальный
гемоглобин (гемоглобин F)
Представляет
собой основную массу гемоглобина с 9 –
13 недельного возраста эмбриона. После
третьего месяца – основной гемоглобин
плода. Затем содержание его постепенно
уменьшается за счет образования с 13 – й
недели гемоглобина А. К моменту рождения
гемоглобина F остается около 20 %, а 80 %
приходится на гемоглобин А. К 4 – 5 месяцу
жизни гемоглобина F остается всего 1 – 2
%. Существует метод цитологической
дифференцировки гемоглобина F путем
обработки мазка крови лимоннокислофосфатной
буферной смесью с рН = 3,4. В этих условиях
эритроциты, содержащие преимущественно
гемоглобин А, подвергаются гемолизу и
представляются на препарате в виде
теней (стром). Эритроциты, в которых
преобладает гемоглобин F, оказываются
резистентными и контрастно окрашиваются.
Гемоглобин
взрослых (гемоглобин А)
Представляет
основную массу гемоглобина взрослых
людей. С помощью электрофореза на
крахмале установлено наличие нескольких
фракций гемоглобина А:
- гемоглобин
A1 (основная
фракция, на долю которой приходится 96
– 98 % всей массы гемоглобина). - гемоглобин
A2 (2
– 5 %). - гемоглобин
A3 (содержание
менее 1 %).
Содержание
гемоглобина F в крови взрослого человека
составляет 1 – 2 %. Повышение этих величин
возможно в условиях патологии. Преобладание
того или иного типа гемоглобина совпадает
во времени с периодами эмбрионального
кроветворения: гемоглобин Р характерен
для периода желточного кроветворения,
гемоглобин F – для печеночного, гемоглобин
А – для периода костномозгового
кроветворения.
Наличие
в эритроцитах людей аномальных или
патологических гемоглобинов определяет
состояния, обозначаемые как гемоглобинозы,
или гемоглобинопатии. Это наследственные
аномалии кроветворения, при которых
молекулы патологических гемоглобинов
имеют измененную структуру, поэтому
подобные заболевания относятся к группе
так называемых молекулярных болезней.
Аномальные гемоглобины различаются
своими физико – химическими свойствами
(электрофоретической подвижностью,
резистентностью к щелочам, растворимостью,
изоэлектрической точкой), а также по
молекулярной структуре глобиновой
части (по одному из пептидов, в котором
изменена последовательность аминокислот).
Появление аномальных гемоглобинов
объясняется мутационной теорией,
передача потомкам аномального гена
осуществляется по законам наследственности.
У гетерозиготных особей (Аа) заболевание
отсутствует или обнаруживаются
субклинические признаки, у гомозиготных
(от брака гетерозиготных особей)
наблюдается развитие тяжелых анемий
гемолитического типа. В настоящее время
установлено более 200 аномальных
гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О,
Р, Q и других, а также возможные их
комбинации (SC, SD и др.). На XVI Международном
конгрессе гематологов (Япония, 1976 г.)
сделаны сообщения о новых аномальных
гемоглобинах: Hb Beth (Nagel, США), Hb Austin
(Moo-Peen, США), Hb Djelfa (Labie, Франция), Hb Hrosaki
(Ohba, Япония), Hb Waco (Moo-Peen, США).
Гемоглобинозы
в гетерозиготной и гомозиготной форме
имеют распространение в экваториальной
Африке, странах, омываемых Средиземным
морем, на Аравийском полуострове, в
Южной Индии, на острове Шри-Ланка, в
Юго-Восточной Азии, Южном Китае, южных
районах США. Причину появления аномальных
гемоглобинов объясняет малярийная
гипотеза, согласно которой мутации в
гене, контролирующем образование
гемоглобина, возникли в странах с широким
распространением тропической малярии.
Было установлено, что наличие аномального
гена в гетерозиготной форме повышает
устойчивость людей к заболеванию,
создает иммунитет к малярии, так как
изменения молекулы гемоглобина
препятствуют использованию его малярийным
плазмодием.
Отличается
от гемоглобина А строением четвертого
пептида, в котором на шестом месте вместо
глутаминовой кислоты находится
электрически нейтральный валин.
Гемоглобин S менее растворим, нейтрален
по заряду, электрофоретически менее
подвижен. В капиллярах при отдаче
кислорода гемоглобин S выпадает в осадок
в форме веретенообразных кристаллоидов
(тактоидов), которые растягивают оболочку
и ведут к распаду эритроцитов. У
гетерозиготов содержание гемоглобина
S равняется 20 – 45 %, у гомозиготов – 60 – 90
%. Гетерозиготная форма аномалии протекает
бессимптомно или сопровождается легкой
гемолитической анемией. У гомозиготных
особей уже с первых месяцев жизни
развивается тяжелая форма серповидноклеточной
анемии.
Характерный
для крови плода фетальный гемоглобин
может быть обнаружен в повышенных
количествах в эритроцитах крови
недоношенных детей, при коклюше,
серповидноклеточной анемии, талассемии,
врожденной микроцитарной анемии,
пернициозной анемии, острых и хронических
лейкозах, миеломной болезни. Наибольшее
содержание (до 97 %) наблюдается при
большой талассемии.
Отличается
строением четвертого пептида молекулы
гемоглобина, в котором на шестом месте
вместо глутаминовой кислоты находится
лизин. Центр распространения гена С –
северная часть Ганы. Частота гетерозиготности
по данным одних авторов, до 15 %, по данным
других, – 16,5 – 28 %, среди негров США – 1,8 –
3% на Ямайке – 2,7 % (В. П. Эфроимсон). Наличие
гена С в гомозиготном состоянии ведет
к развитию выраженной спленомегалии,
умеренной микроцитарной анемии с
наличием эритроцитов мишеневидной
формы. При наличии комбинации гемоглобинов
С и S анемия оказывается более тяжелой.
Обнаружен
у 2 % берберов Марокко и у 0,4 % негров США.
У гомозиготов наблюдается микроцитоз,
слабый анизо- и пойкилоцитоз и
мишеневидность эритроцитов. Описано
несколько гемоглобинов D (в северо-западной
Индии, среди сикхов в Индии, на острове
Кипр, в Турции).
Обнаружен
у жителей Юго-Восточной Азии: в Кампучии,
Таиланде, Бирме, Бенгалии, у веддов
Шри-Ланки, в северо-восточной Малайе, у
населения Калимантана и Сулавеси.
Частота распространения гена С в разных
местностях колеблется от 1 – 3 до 13
(Таиланд) – 20 (Бирма) – 28 – 37 % (Кампучия). У
гомозиготов ЕЕ наблюдается микроцитоз,
компенсируемый развитием эритроцитоза
(до 7 – 8 x 1012 /л).
Отмечены комбинации генов ES и ЕТ, дающие
сублетальный эффект. Клинические
проявления при других гемоглобинозах
выражены слабо, а распространение более
ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Серповидноклеточная
анемия – тяжёлое наследственное
заболевание, обусловленное точечной
мутацией гена, кодирующего структуру
β-цепи гемоглобина (см. раздел 4). В
результате в эритроцитах больных
присутствует HbS, β-цепи которого в шестом
положении вместо гидрофильной глутаминовой
кислоты содержат гидрофобную аминокислоту
валин. Появление гидрофобной аминокислоты
недалеко от начала молекулы способствует
возникновению нового центра связывания,
поэтому при низком парциальном давлении
кислорода тетрамеры дезокси-HbS ассоциируют,
образуя длинные микротрубчатые
образования, которые полимеризуются
внутри эритроцитов. Полимеризация
приводит к нарушению структуры
эритроцитов, они приобретают серповидную
форму и легко разрушаются. При этом
заболевании отмечают анемию, прогрессирующую
слабость, отставание в развитии и
желтуху.
Носители
гена серповидноклеточной анемии чаще
всего встречаются среди африканского
населения, так как они приобретают
некоторое преимущество при заболевании
малярией, часто встречающейся в странах
с тропическим климатом. Причина сохранения
гена серповидноклеточной анемии в
популяции связана с тем, что в эритроцитах
гетерозигот хуже развивается малярийный
плазмодий, часть жизненного цикла
которого проходит в эритроцитах человека.
В связи с этим гетерозиготные носители
дефектного
гена
выживали при эпидемиях малярии, однако
четверть их потомства погибала от
серповиднок-леточной анемии.
Талассемии –
наследственные заболевания, обусловленные
отсутствием или снижением скорости
синтеза α- или β-цепей гемоглобина. В
результате несбалансированного
образования глобиновых цепей образуются
тетрамеры гемоглобина, состоящие из
одинаковых протомеров. Это приводит к
нарушению основной функции гемоглобина
– транспорту кислорода к тканям. Нарушение
эритропоэза и ускоренный гемолиз
эритроцитов и клеток-предшественников
при талассемиях приводит к анемии.
При
β-талассемии не синтезируются β-цепи
гемоглобина. Это вызывает образование
нестабильных тетрамеров, содержащих
только α-цепи. При этом заболевании в
костном мозге из-за преципитации
нестабильных α-цепей усиливается
разрушение эритробластов, а ускорение
разрушения эритроцитов в циркулирующей
крови приводит к внутрисосудистому
гемолизу. Как известно, для образования
фетального гемоглобина р-цепи не
требуются (см. раздел 4), поэтому клинически
β-талассемия не проявляется до рождения,
после чего происходит переключение
синтеза HbF на НBА.
В
случае α-талассемии недостаток образования
α-глобиновых цепей приводит к нарушению
образования HbF у плода. Избыточные γ-цепи
образуют тетрамеры, называемые
гемоглобином Барта. Этот гемоглобин
при физиологических условиях имеет
повышенное сродство к кислороду и не
проявляет кооперативных взаимодействий
между протомерами. В результате гемоглобин
Барта не обеспечивает развивающийся
плод необходимым количеством кислорода,
что приводит к тяжёлой гипоксии. При
α-талассемии отмечают высокий процент
внутриутробной гибели плода. Выжившие
новорождённые при переключении с γ- на
β-ген синтезируют β-тетрамеры или НBН,
который, подобно гемоглобину Барта,
имеет слишком высокое сродство к
кислороду, менее стабилен, чем НBА и
быстро разрушается. Это ведёт к развитию
у больных тканевой гипоксии и к смерти
вскоре после рождения.
Наследственный
сфероцитоз. Причиной
этой патологии чаще всего является
дефект белков цитоскелета эритроцитов
– спектрина или ан-кирина, которые
обеспечивают поддержание двояковогнутой
формы клетки и эластичности мембраны.
Эритроциты приобретают шарообразную
форму, что приводит к уменьшению площади
их поверхности и снижению скорости
газообмена. Потеря эластичности клеточной
мембраны приводит к повышению хрупкости
и травматичности клеток и, как следствие,
к ускорению их разрушения в сосудистом
русле и селезёнке. Заболевание
сопровождается анемией и желтухой.
Удаление селезёнки (спленэктомия) при
наследственном сфероцитозе улучшает
состояние больных, так как предотвращает
разрушение сфероцитов в селезёнке.
Мегалобластная
(макроцитарная) анемия развивается
при дефиците фолиевой кислоты или
витамина В12.
Фолиевая
кислота в виде кофермента (Н4-фолата)
участвует в синтезе нуклеотидов.
Недостаток фолиевой кислоты приводит
к снижению скорости синтеза ДНК в
быстроделящихся клетках, и в первую
очередь в предшественниках эритроцитов.
Клетки дольше пребывают в интерфазе,
синтезируя гемоглобин, и становятся
крупнее. Кроме того, из-за недостатка
нуклеотидов они реже делятся, и количество
эритроцитов снижается, а крупные
мегалобласты быстрее разрушаются. Всё
это в конечном итоге приводит к развитию
анемии.
Аналогичная
симптоматика развивается при недостатке
в организме витамина В12.
Этот витамин участвует в переносе
метальной группы с N5-метил-Н4-фолата
на гомоцистеин с образованием метионина
и Н4-фолата
(см. раздел 10). Недостаточность витамина
В12 приводит
к накоплению N5-метил-Н4-фолата
в клетках. Дефицит Н4-фолата
приводит к нарушению деления клеток и
развитию анемии.
97.
Биосинтез гема. Схема процесса, химизм
первых двух реакций, место протекания.
Регуляция активности ферментов
АЛК-синтазы и АЛК-дегидратазы. Источники
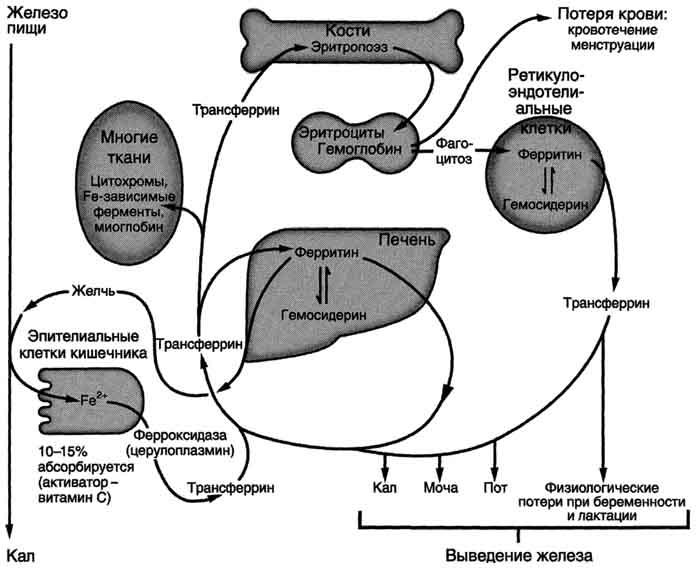
железа для синтеза гема, всасывание
железа, транспорт в крови, депонирование.
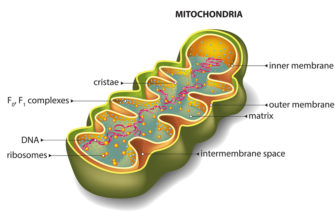
Гем
синтезируется во всех тканях, но с
наибольшей скоростью в костном мозге
и печени (рис. 13-2). В костном мозге гем
необходим для синтеза гемоглобина в
ретикулоцитах, в гепатоцитах – для
образования цитохрома Р450.
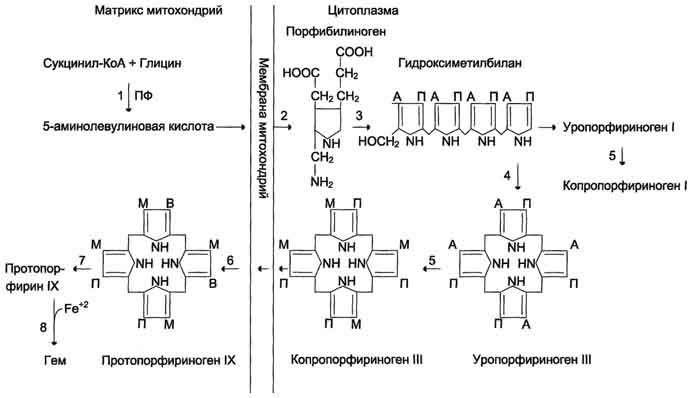
Рис.
13-2. Синтез гема. Цифрами
на схеме указаны ферменты: 1 –
аминолевулинатсинтаза; 2 –
аминолевулинатдегидратаза; 3 –
порфобилиногендезаминаза; 4 – уропорфириноген
III косинтаза; 5 – уропорфириногендекарбоксилаза;
6 – копропорфи-риноген III оксидаза; 7 –
протопорфириногеноксидаза; 8 –
феррохелатаза. Буквами обозначены
заместители в пиррольных кольцах: М –
метил, В – винил, П – остатки пропионовой
кислоты, А – ацетил, ПФ – пиридоксальфосфат.
Донором железа служит депонирующий
железо в клетках белок ферритин.
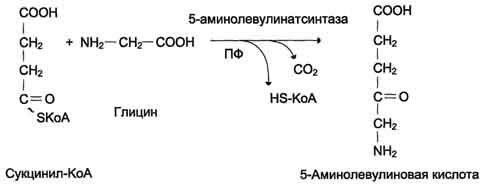
Рис.
13-3. Реакция образования 5-аминолевулиновой
кислоты.
В.
Регуляция биосинтеза гема
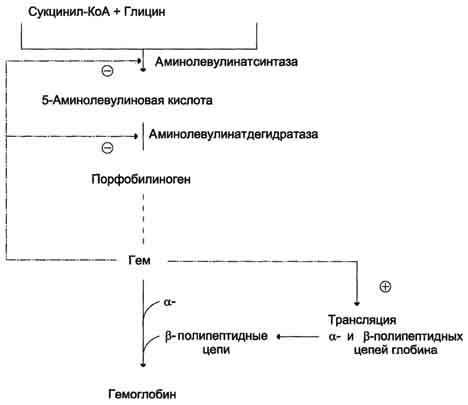
Регуляция
синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина.
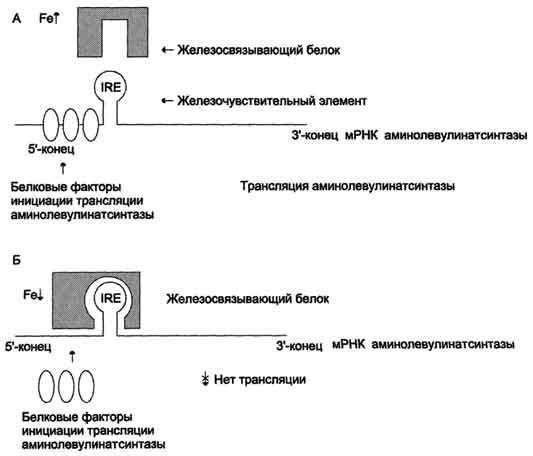
Регуляция
синтеза аминолевулинатсинтазы. А
– при высокой концентрации железа в
ретикулоцитах оно присоединяется к
железосвязывающему белку и снижает
сродство этого белка к железочувствительному
элементу (IRE) матричной РНК, кодирующей
аминолевулинатсинтазу. Белковые факторы
инициации трансляции связываются с
мРНК и инициируют трансляцию
аминолевулинатсинтазы. Б – при низком
содержании железа в ретикулоцитах
железосвязывающий белок обладает
высоким сродством к IRE и взаимодействует
с ним. Белковые факторы инициации
трансляции не могут присоединиться к
мРНК, и трансляция прекращается.
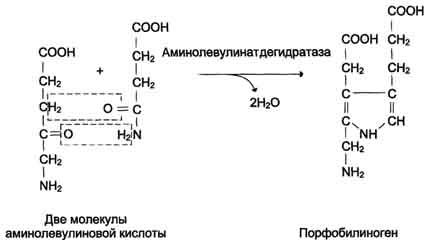
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Соседние файлы в предмете Биохимия
- Гемоглобин
- Что это такое
- Норма гемоглобина
- Норма гемоглобина у детей
- Норма гемоглобина у взрослых
- Гемоглобин понижен
- Патологические причины
- Гемоглобин повышен
- Когда нужно проверять уровень гемоглобина
- Как подготовиться к исследованию
- Что может повлиять на результат анализа
- Сколько готовится анализ на гемоглобин
- Частые вопросы
- Вам может быть интересно
- Транспорт для кислорода
- Особенность гемоглобина — способность легко присоединять кислород в насыщенной им среде.
- Когда гемоглобина не хватает?
- Анемия во всей красе
- А если гемоглобина много?
Гемоглобин

Гемоглобин — сложный железосодержащий белок, который находится внутри эритроцитов (красных кровяных телец) и выполняет жизненно важную функцию: доставляет кислород от лёгких к тканям, а обратно в лёгкие уносит углекислый газ.
Гемоглобин: что это такое
Гемоглобин понижен: симптомы
Гемоглобин понижен: причины
Гемоглобин повышен: симптомы
Гемоглобин повышен: причины
Когда нужно проверять уровень гемоглобина
Что это такое
Гемоглобин — белок, который содержится в эритроцитах и выполняет жизненно важную функцию: переносит кислород от лёгких в ткани и органы, а обратно в лёгкие транспортирует углекислый газ.
Вместе с эритроцитами гемоглобин образуется в костном мозге и циркулирует в кровотоке в течение всей жизни красных кровяных телец — около 120 дней. Когда эритроциты разрушаются, большая часть гемоглобина выводится из организма вместе с ними. Некоторое количество гемоглобина поступает обратно в кровоток — чтобы присоединиться к новым эритроцитам.
Молекула гемоглобина состоит из двух частей:
- Гем — небелковая часть, соединение порфирина с железом. В каждой молекуле гемоглобина — четыре гема.
- Глобин — белок, составляющий 96% всей массы гемоглобина и состоящий из четырёх цепочек.
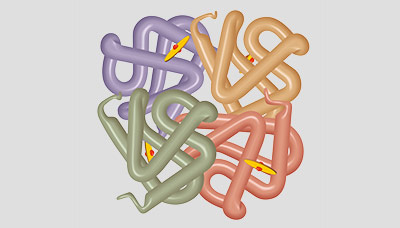
Структура гемоглобина: четыре цепочки глобина и четыре гема, внутри которых находятся атомы железа (на рисунке обозначены жёлтыми дисками с красными центрами).
Гемоглобин, который захватил кислород из лёгких и несёт его к тканям и органам, называется оксигемоглобин. Он находится в артериальной крови, идущей от лёгких, и придаёт ей ярко-алый цвет.
Добравшись до пункта назначения, оксигемоглобин выгружает кислород, а взамен забирает отработанный углекислый газ — так образуется карбгемоглобин.
Карбогемоглобин циркулирует в венозной крови (идёт от тканей и органов к лёгким) и придаёт ей вишнёвую окраску.
Помимо оксигемоглобина и карбогемоглобина, в организме могут обнаруживаться и другие виды гемоглобина:
- Карбоксигемоглобин — соединение гемоглобина и угарного газа. Образуется при вдыхании большого количества CO. В группе риска — работники металлургических предприятий, химических заводов, а также люди, которые занимаются наладкой холодильного оборудования и электросварочными работами. Избыток карбоксигемоглобина может привести к кислородному голоданию, головокружениям, рвоте, тошноте, а иногда даже к смерти.
- Метгемоглобин — гемоглобин, который больше не может переносить кислород из-за того, что железо в нём окислилось. В минимальной концентрации присутствует в крови здорового человека. Метгемоглобин в избыточном количестве может образовываться при острых химических отравлениях, некоторых наследственных заболеваниях (семейная метгемоглобинемия).
- Гликированный гемоглобин — соединение гемоглобина и глюкозы. Если уровень сахара в крови повышается, то молекулы глюкозы начинают склеиваться с молекулами гемоглобина. Это бывает при сахарном диабете, болезнях поджелудочной железы, нарушениях обмена веществ, лечении глюкокортикоидами.
Определение уровня гликированного гемоглобина в крови используется для оценки углеводного обмена, выраженности и давности его нарушений.
Анализ на гликированный гемоглобин можно сдать отдельно или в составе комплексных исследований, оценивающих и другие параметры: уровень глюкозы, индекс инсулинорезистентности HOMA-IR (определение чувствительности клеток к инсулину).
Вен. кровь (+140 ₽)

66 бонусов на счёт
123 бонуса на счёт
Норма гемоглобина
Норма гемоглобина (Hb) зависит от пола и возраста пациента.
У женщин, как правило, уровень гемоглобина ниже из-за ежемесячной потери крови во время менструации.
У мужчин гемоглобин выше по двум основным причинам:
- Физиология мужчин не предполагает ежемесячных кровопотерь, а значит, уровень гемоглобина может сохраняться на более высоком уровне.
- Из-за тестостерона, мужского полового гормона, у сильного пола больше мышечная масса, которая нуждается в кислороде. Для обеспечения этой потребности в норме вырабатывается больше гемоглобина.
У детей наиболее высокий уровень гемоглобина отмечается в первые дни жизни — это связано с тем, что запас железа ребёнка сформирован ещё во время внутриутробного развития. Спустя месяц после рождения запасы постепенно истощаются, уровень гемоглобина снижается. Затем к концу первого года жизни постепенно нарастает до нормальных значений.
Норма гемоглобина у детей
В первые две недели после рождения концентрация гемоглобина у детей достаточно высокая: 150–240 г/л. Затем показатель снижается: для детей в возрасте 1 месяца он составляет 90–166 г/л, в возрасте 2 месяцев — 92–150 г/л, в возрасте 6 месяцев — 101–132 г/л.
После 12 лет уровень гемоглобина зависит не только от возраста, но и от пола. Так, для мальчиков 12–14 лет оптимальным считают значение 120–160 г/л, для девочек — чуть ниже, 115–150 г/л.
Норма гемоглобина у взрослых
Норма гемоглобина у женщин в возрасте 18–44 лет — 117–155 г/л, у мужчин — 132–173 г/л. С возрастом концентрация гемоглобина постепенно снижается.
Норма гемоглобина у мужчин
Гемоглобин понижен
Низкий уровень гемоглобина не всегда проявляет себя яркими симптомами. Пациенты зачастую не обращают внимания на то, что кожа стала бледной и сухой, по краям губ образовались трещины, ногти стали ломкими. Однако игнорировать эти признаки не стоит.
Основные симптомы низкого гемоглобина:
- сухая бледная кожа;
- трещинки в уголках губ;
- ломкие безжизненные волосы;
- ломкие ногти;
- снижение аппетита;
- нарушение стула (чередование запоров и диареи);
- беспричинное повышение температуры до 37,5 °С;
- упадок сил;
- головокружение;
- учащённое сердцебиение;
- настойчивые головные боли;
- низкое артериальное давление;
- дискомфорт в ногах (когда хочется постоянно ими шевелить, просто чтобы избавиться от неприятных ощущений).

Один из симптомов пониженного гемоглобина — тусклые безжизненные волосы
Если уровень гемоглобина в крови понижен — это не всегда означает, что пациент болен. Такое состояние может быть вызвано травмой или операцией, недавней кровопотерей, систематическим донорством, особенностями питания (вегетарианство, низкокалорийные диеты).
У женщин лёгкая анемия бывает в период менструации — такое состояние считается вариантом нормы. Также снижение уровня гемоглобина может возникнуть во время беременности. Это связано с тем, что объём циркулирующей плазмы возрастает на 40–50%, а количество эритроцитов — всего на 20–35%. То есть кровь становится более «разбавленной».
Согласно рекомендациям ВОЗ (Всемирной организации здравоохранения), допустимый нижний уровень гемоглобина у беременных — 110 г/л.
Патологические причины
Патологическое снижение уровня гемоглобина, вызванное низкой концентрацией эритроцитов, называют анемией. При анемии часто кружится голова, мёрзнут ноги, бледнеет кожа.
Анемия по степени тяжести:
- Лёгкая: уровень гемоглобина — 90–110 г/л. Симптомы часто отсутствуют. Иногда ухудшается работоспособность, память, повышается пульс, бывают головокружения. Может темнеть в глазах, особенно если резко встать с кресла или кровати.
Средняя: 70–90 г/л. Проявляется частыми головокружениями, бессонницей, сонливостью днём, шумом в ушах, одышкой, головными болями, бледностью кожи. У пациента могут появиться отёки под глазами, особенно заметные по утрам. - Тяжёлая: менее 70 г/л. Нарастает мышечная слабость, появляются трудности с перевариванием пищи, повышается температура. Часто наблюдается недержание мочи по ночам.
- Критически низкая — 40 г/л. Опасное для жизни состояние, которое требует немедленной госпитализации.
313 бонусов на счёт
Возможные патологические причины анемии:
- острая кровопотеря при кровотечениях;
- хроническая кровопотеря при геморрое, желудочно-кишечных, маточных и десневых кровотечениях;
- заболевания желудочно-кишечного тракта, при которых нарушается всасывание железа (колит, энтероколит, дисбактериоз кишечника);
- заболевания костного мозга, при котором он перестаёт производить красные клетки крови в достаточном количестве: лейкоз (рак костного мозга), в том числе лимфома (злокачественная – опухоль, которая поражает лимфоциты — один из видов лейкоцитов), апластическая анемия (угнетение кроветворной функции костного мозга);
- почечная недостаточность, при которой почки не вырабатывают достаточно гормона эритропоэтина, стимулирующего синтез красных кровяных телец;
- заболевания, при которых эритроциты интенсивно разрушаются: серповидноклеточная анемия, талассемия (наследственная болезнь крови).
Гемоглобин повышен
Принято считать, что повышенная концентрация гемоглобина — это значение, которое больше верхней границы нормы на 20 г/л.
Симптомы повышенного уровня гемоглобина:
- упадок сил;
- постоянная сонливость;
- головокружения с розовой пеленой перед глазами;
- боли в суставах;
- головная боль, опоясывающая «обручем»;
- зуд, шелушение, сухость кожи;
- боль и спазмы в животе;
- обширные гематомы в местах ушибов.
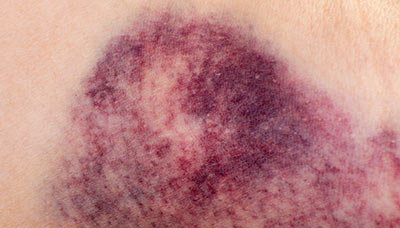
Обширные гематомы в местах ушибов — один из признаков повышенного уровня гемоглобина
Яркость симптомов увеличивается при физической активности. В покое они могут быть практически незаметны.
У здоровых людей уровень гемоглобина может быть повышен на фоне дефицита кислорода (такое состояние встречается у жителей крупных мегаполисов, жителей высокогорных районов, а также лётчиков) или из-за дефицита жидкости в организме при восстановлении после отравлений, интенсивных физических нагрузках.
Высокий уровень гемоглобина может указывать на ряд патологических состояний и заболеваний.
Причины патологического повышения уровня гемоглобина:
- Эритремия (болезнь Вакеза) — хроническое заболевание кроветворной системы, при котором в крови увеличивается концентрация эритроцитов, лейкоцитов и тромбоцитов.
- Сердечная недостаточность — состояние, при котором работа сердца нарушается, ткани и органы не получают крови в достаточном количестве. При этом в почках начинает активно вырабатываться гормон эритропоэтин, который стимулирует синтез эритроцитов.
- Дыхательная недостаточность — недостаточное поступление кислорода. Чаще всего уровень гемоглобина повышается при хронических болезнях бронхов и лёгочной ткани.
- Онкологические заболевания. Как правило, при злокачественных процессах уровень гемоглобина снижается, но есть и исключения. При раке печени, почек, надпочечников опухоль может влиять на уровень эритропоэтина, а тот в свою очередь стимулирует выработку гемоглобина. Некоторые разновидности лейкоза сопровождаются избыточным синтезом красного ростка кроветворения.
- Перегрузка железом. Не всегда, но часто гемоглобин повышается при наследственном гемохроматозе, когда в кишечнике из-за генетического дефекта всасывается больше железа, чем нужно. Повышение гемоглобина является признаком предельного насыщения организма железом.
Когда нужно проверять уровень гемоглобина
Гемоглобин определяют в общеклиническом анализе крови и оценивают вместе с эритроцитами и показателями обмена железа.
Проверить уровень гемоглобина стоит, если есть тревожные симптомы анемии или, наоборот, повышенной концентрации этого белка.
- беременность;
- если в семье были болезни крови (например, серповидноклеточная анемия);
- у пациента есть инфекционное или вирусное заболевание;
- недавно пациент потерял много крови из-за травмы или операции;
- в рационе недостаточно продуктов, содержащих железо.
Базовые исследования — общий и клинический анализы крови — дают информацию об уровне гемоглобина и состоянии здоровья в целом.
22 бонуса на счёт
44 бонуса на счёт
Комплексное исследование «Анемия» поможет выяснить причины возникновения анемии и её тип. В исследование входит общий анализ крови с лейкоцитарной формулой, СОЭ по Вестергрену, определение уровня фолатов, витамина B12 и другие показатели, позволяющие установить верный диагноз.
Если уровень гемоглобина в крови ниже нормы, врач может назначить дополнительные исследования, чтобы выяснить причины анемии.
Биохимический анализ крови даёт информацию о состоянии внутренних органов пациента. Анализ мочи позволяет оценить работу почек. Анализ кала на скрытую кровь помогает выявить скрытые внутренние кровотечения.
30 бонусов на счёт
Врачи рекомендуют проверять гемоглобин как минимум раз в год. Это позволит на самом раннем этапе обнаружить патологию и начать лечение.
Как подготовиться к исследованию
Анализ крови на гемоглобин нужно сдавать натощак, с 8 до 11 часов утра. В течение дня показатели крови могут существенно меняться, результат утреннего анализа — самый достоверный.
За 24 часа до теста следует исключить алкоголь и воздержаться от интенсивных физических нагрузок.
За 8 часов до взятия крови не следует есть, а также пить соки, молоко или другие напитки. Можно пить негазированную воду. Накануне исследования лучше поужинать лёгкой, нежирной пищей.
За 1–2 часа до анализа желательно не курить, избегать стресса и физического напряжения (бег, быстрый подъём по лестнице).
За 15 минут до взятия крови желательно немного отдохнуть: посидеть в лабораторном отделении, отдышаться, успокоиться.
Что может повлиять на результат анализа
На результат анализа могут повлиять лекарства и медицинские процедуры.
Уровень гемоглобина может быть повышен после травмы или операции, недавней кровопотери. У женщин показатель может быть снижен на фоне менструации или беременности.
Уровень гемоглобина может быть повышен из-за кислородного голодания или дефицита жидкости в организме, а также после интенсивных физических нагрузок.
Сколько готовится анализ на гемоглобин
Базовые исследования уровня гемоглобина (общий и клинический анализы крови) готовятся в Лаборатории Гемотест один день, не считая дня взятия биоматериала.
Частые вопросы
Гемоглобин — это белок крови, который содержится внутри эритроцитов и выполняет в организме важную функцию: доставляет кислород от лёгких к тканям, а обратно в лёгкие уносит углекислый газ.
Главная функция гемоглобина — переносить кислород от лёгких к тканям и органам, а обратно в лёгкие доставлять углекислый газ.
Критически низким уровнем гемоглобина считается показатель 40 г/л. Такое состояние требует немедленной госпитализации пациента.
Норма гемоглобина у мужчин старше 50 лет — 131–172 г/л.
Норма гемоглобина у женщин 40–44 лет — 117–155 г/л, 45–64 лет — 117–160 г/л.
Если часто кружится голова, мёрзнут ноги и бледнеет кожа — это могут быть признаки пониженного уровня гемоглобина. Однако во многих случаях дефицит гемоглобина не проявляет себя симптомами. Узнать уровень гемоглобина и вовремя начать лечение поможет лабораторная диагностика.
Информацию проверил врач-эксперт

Врач-невролог, кандидат медицинских наук
Информация из данного раздела не может служить достаточным основанием для постановки диагноза или назначения лечения. Решение об этом должен принимать врач на основании всех имеющихся у него данных.
Вам может быть интересно
Вам телеграм.
Telegram-канал, которому, на наш взгляд, можно доверять
Мы много о нём слышали и точно знаем, что гемоглобин — это что-то очень хорошее и нужное для здоровья. Но что именно? Давайте разбираться.
Транспорт для кислорода
Гемоглобин — сложный белок, который вырабатывается в красных клетках крови — эритроцитах. Он состоит из аминокислотных цепей, содержащих гем — соединение железа.
Особенность гемоглобина — способность легко присоединять кислород в насыщенной им среде.
Этот процесс происходит в капиллярах лёгких: их стенки настолько тонкие, что кислород, поступающий со вдыхаемым воздухом, без сложностей проникает в кровяное русло. С каждой молекулой гемоглобина может связываться одновременно четыре молекулы О, после чего ко всем органам и тканям направляется кровь, богатая жизненно важным газом. Там он «открепляется» от белка, а на освободившиеся участки может присоединяться углекислый газ, который транспортируется с током крови обратно в лёгкие, чтобы там покинуть организм с выдыхаемым воздухом.
Интересно, что именно гемоглобин придаёт эритроцитам форму, напоминающую пончики с небольшим углублением в центре, а пигмент, содержащийся в белке, обеспечивает красный цвет крови.
Когда гемоглобина не хватает?
В норме у женщин уровень гемоглобина должен быть не менее 120 г/л, а у мужчин — не менее 130 г/л. Если показатели оказываются ниже этого порога, говорят об анемии (от греческого «бескровие»). Надо понимать, что это очень распространённое состояние, которое обычно связано с дефицитом железа в организме — железодефицитной анемией. Более чем в ста странах мира её признают государственной проблемой, решением которой занимаются целые системы здравоохранения.
Чаще всего железодефицитная анемия становится следствием кровопотери. Источник её может быть очевиден, например, чересчур обильные у женщин или диагностированная кровоточащая язва, или неизвестен, как в случае с хроническим кровотечением в толстом кишечнике. Ещё одна причина недостаточности железа — : будущей маме для развития плаценты и малыша нужно в пять-шесть раз больше этого элемента, чем до зачатия.

Реже железодефицитная анемия развивается из-за нарушения всасывания железа в желудочно-кишечном тракте. Как правило, это бывает у людей с определёнными заболеваниями, например, целиакией, аутоиммунным гастритом, хеликобактерной инфекцией и другими формами воспаления в желудочно-кишечном тракте. И наконец, вполне вероятен железодефицит при несбалансированном рационе и недостаточном поступлении
Анемия во всей красе
Железодефицитная анемия может протекать бессимптомно и выявляться случайно при рутинном анализе крови. Но если показатели падают слишком низко, проявлений не избежать. Кстати, они неспецифичны и могут возникать при множестве других самых разных заболеваний и состояний, поэтому диагноз на их основании установить нельзя:
- одышка, учащённое сердцебиение;
- трудности при физических нагрузках;
- язвенные поражения языка;
- синдром беспокойных ног;
- желание есть несъедобные или не очень съедобные вещи, например, глину, бумагу, кукурузный крахмал, лёд.
Когда диагноз установлен, дело за малым — лечением, а оно не представляет сложностей. При железодефицитной анемии назначают , которые, как правило, позволяют довольно быстро нормализовать ситуацию и компенсировать недостаточность.
А если гемоглобина много?
Менее опасная и довольно редкая причина — обезвоживание. Очевидно, что в организме, испытывающем дефицит жидкости, кровь «сгущается», и уровень гемоглобина искусственно увеличивается. Кстати, повышенным считается содержание у женщин выше 150 г/л, а у мужчин — более 170 г/л.
Известны состояния, при которых уровень гемоглобина остаётся нормальным, но его структура нарушается, что влечёт изменение формы эритроцитов и сопряжённые с ним серьёзные проблемы со здоровьем. Однако они встречаются, к счастью, редко. В отличие от хорошо знакомой многим железодефицитной анемии, симптомов которой вполне достаточно, чтобы оценить, насколько важен для нас этот ценный белок — гемоглобин.
Мнение автора может не совпадать с мнением редакции