ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ В ЖИВЫХ
ОРГАНИЗМАХ. БИОЭНЕРГЕТИКА
Живые организмы
находятся в постоянной и неразрывной
связи с окружающей средой. Эта связь
осуществляется в процессе обмена
веществ.
Обмен веществ включает 3 этапа: поступление
веществ в организм, метаболизм или
промежуточный обмен и выделение конечных
продуктов из организма.
Поступление веществ
в организм происходит в результате
дыхания (кислород) и питания. В ЖКТ
продукты питания перевариваются
(расщепляются
до простых веществ),
всасывающихся в кровь и включающихся
в промежуточный обмен. Промежуточный
обмен (внутриклеточный метаболизм)
включает 2 типа реакций: катаболизм и
анаболизм.
Катаболизм —
процесс расщепления органических
молекул до конечных продуктов. Конечные
продукты превращений органических
веществ у животных и человека — СО2,
Н2О
и мочевина.
В процессы катаболизма включаются
метаболиты, образующиеся как при
пищеварении, так и при распаде
структурно-функциональных компонентов
клеток. Реакции катаболизма сопровождаются
выделением энергии.
Анаболизм
объединяет биосинтетические процессы,
в которых молекулы-предшественники
соединяются в сложные макромолекулы,
необходимые для организма. В анаболических
реакциях используется энергия,
освобождающаяся при катаболизме.
С
вязь
процессов катаболизма и анаболизма
можно представить следующей схемой:
Образование
молекулы АТР, главного источника энергии
для совершения работы в биологических
системах, сегодня не может быть описано
в терминах точного химического механизма
элементарных стадий, однако ясно, что
движущей силой процесса служит энергия
электрического поля, существующего на
внутренней мембране митохондрий.
Возникает естественный вопрос: что
служит источником этой энергии? В самом
общем виде ответ можно сформулировать
так. Питательные вещества (белки, жиры
и углеводы) в конечном счете превращаются
в ограниченный набор низкомолекулярных
соединений — органических кислот.
Углеродные атомы, из которых построены
эти кислоты, окисляются (у аэробных
организмов кислородом) до углекислого
газа и воды. Процесс окисления органических
кислот кислородом происходит в
митохондриях — клеточных органеллах,
обеспечивающих бóльшую часть синтеза
АТР в клетках. Потребление кислорода в
качестве окислителя обычно называют
внутриклеточным дыханием. Энергия,
освобождающаяся в результате химической
реакции окисления, превращается в
электрохимическую и в таком виде
используется для синтеза АТР.
Биологическое
окисление определяется
как совокупность реакций окисления
органических веществ (субстратов),
выполняющих функцию энергетического
обеспечения потребностей организма.
Согласно СОВРЕМЕННОЙ
ТЕОРИИ БИООКИСЛЕНИЯ окисление может
происходить двумя способами:
1. Путем отнятия
водорода от окисляемого субстрата: сюда
относятся МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ
и ВНЕМИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ
ОКСИДАЗНОГО ТИПА.
2. Путем присоединения
кислорода к окисляемому субстрату – так
происходит внемитохондриальное ОКИСЛЕНИЕ
ОКСИГЕНАЗНОГО ТИПА ИЛИ СВОБОДНОЕ
ОКИСЛЕНИЕ.
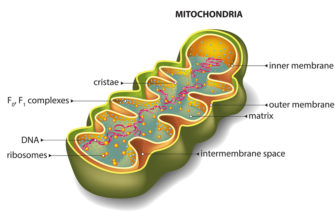
Митохондрии
представляют
собой мембранные
полуавтономные органеллы, обеспечивающие
клетку энергией, получаемой
благодаря процессам окисления и
запасаемой в виде фосфатных
связей АТФ. Митохондрии
также участвуют в биосинтезе стероидов,
окислении жирных кислот и синтезе
нуклеиновых кислот.
Митохондрии
могут иметь эллиптическую, сферическую,
палочковидную, нитевидную и др. формы,
которые могут изменяться в течение
определенного времени. Их размеры
составляют 0.2-2 мкм в ширину и 2-10 мкм в
длину, а количество в различных клетках
варьирует в широких пределах, достигая
в наиболее активных 500-1000. В клетках
печени (гепатоцитах)
их
число составляет около 800, а занимаемый
ими объем равен примерно 20% объема
цитоплазмы. На светооптическом уровне
митохондрии выявляются в цитоплазме
специальными методами и имеют вид мелких
зерен и нитей (что обусловило их название
– от греч. mitos
– нить и chondros
– зерно).
В
цитоплазме митохондрии могут располагаться
диффузно, однако обычно они сосредоточены
в участках максимального потребления
энергии, например,
вблизи ионных насосов, сократимых
элементов (ми-офибрилл), органелл движения
(аксонем спермия, ресничек), компонентов
синтетического аппарата (цистерн ЭПС).
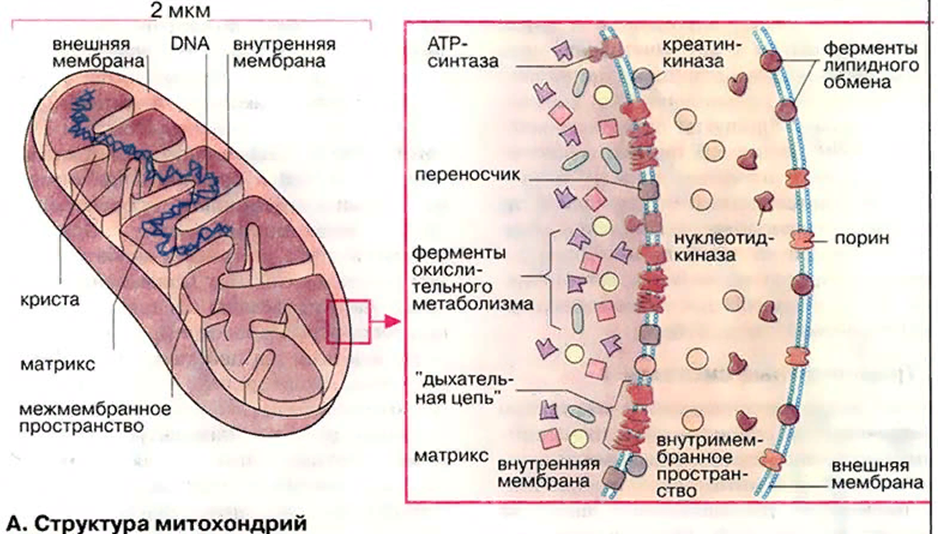
Митохондрии
состоят из наружной
и
внутренней
мембран, разделенных
межмембранным
пространством, и
содержат митохондриаль-ный
матрикс, в
который обращены складки внутренней
мембраны -кристы
(рис.
3-12).
рикс,
МГ – митохондриальные гранулы, МК –
мембрана кристы, ЭЧ – элементарные
частицы, Г – головка, Н – ножка.
(1)
наружная митохондриальная мембрана
напоминает
плазмо-лемму и обладает высокой
проницаемостью для молекул массой до
10 килодальтон, проникающих из цитозоля
в мемжмембранное пространство. Она
содержит много молекул специализированных
транспортных
белков (например,
порин),
которые
формируют широкие гидрофильные каналы
и обеспечивают ее высокую проницаемость,
а также небольшое количество ферментных
систем. На
ней находятся рецепторы,
распознающие
белки, которые переносятся через обе
митохондриальные мембраны в особых
точках их контакта • зонах
слипания.
(2)
внутренняя митохондриальная мембрана
отделена
от наружной межмембранным
пространством шириной
10-20 нм, которое содержит небольшое
количество ферментов. В ее состав входят
белки трех типов: (а)
транспортные белки, (б) ферменты
дыхательной цепи и сукцинатдегидрогеназаназа
(СДГ), в) комплекс АТФ-синтетазы. Низкая
проницаемость внутренней мембраны для
мелких ионов из-за высокого содержания
фосфолипида кардиолипина имеет большое
значение для функции митохондрий, так
как она обеспечивает возможность
создания электрохимических градиентов
при продукции высокоэнергетических
метаболитов клетки.
Кристы
– складки
внутренней мембраны толщиной 20 нм;
располагаются чаще всего перпендикулярно
длиннику митохондрии, но могут лежать
и продольно. Их число и площадь
пропорциональны активности митохондрии.
На кристах находятся элементарные
(грибовидные) частицы, называемые
также оксисомами
или F
^частицами, в
количестве 104-105,
состоящие из головки
диаметром
9 нм и ножки
толщиной
3 нм (см. рис 3-12). На них происходит
сопряжение
процессов
окисления и фосфорилирования. В области
округлой головки частицы осуществляется
синтез
АТФ из ЛДФ. Разобщение метаболических
процессов окисления и фосфорилирования
приводит к образованию значительного
количества тепла
вместо
накопления энергии в форме макроэргических
соединений. Такое разобщение характерно,
например, для митохондрий клеток бурой
жировой ткани, специализированной на
продукции тепла (термогенезе).
Оно
обусловлено присутствием в них особого
белка UCP
(сокр.
от англ, uncoupling
protein
– разобщающий белок), или тер-могенина,
варианты
которого в последние годы обнаружены
в митохондриях клеток различных
тканей. Высказано предположение, что
склонность к развитию некоторых
метаболических заболеваний, например,
ожирения,
может
определяться нарушениями выработки
или функции этих белков.
Форма
крист – в
митохондриях большинства клеток –
пластин-штая
(ламеллярная); в
некоторых клетках встречаются кристы
в виде грубочек и пузырьков –
тубулярно-везикулярные
кристы (рис.
3-13). !оследний вариант характерен для
клеток, синтезирующих стероидные
гормоны
(клетки
коркового вещества надпочечников,
фолликулярные клетки и клетки желтого
тела яичника, клетки Лейдига яичка). В
таких клетках ферменты стероидогенеза
локализуются частично в аЭПС, а частично
– на внутренней митохондриальной
мембране. В ходе синтеза стероидов
промежуточные продукты неоднократно
перемещаются между этими органеллами.
(3)
митохондриалъный матрикс
–
гомогенное
мелкозернистое вещество умеренной
плотности, заполняющее полость (внутреннюю
камеру) митохондрии
и содержащее несколько сотен ферментов:
растворимые
ферменты цикла Кребса (за исключением
СДГ), ферменты, участвующие в окислении
жирных кислот, ферменты белкового
синтеза. В матриксе находятся также
митохондриальные
рибосомы, митохонд-риальные гранулы и
митохондриальная ДНК (что
отличает митохондрии от всех остальных
оргапелл).
Митохондриальные
рибосомы имеют
вид мелких плотных гранул, распределенных
в матриксе. Белки, образующие эти
рибосомы, лишь частично продуцируются
в самой митохондрии.
Митохондриальные
гранулы – частицы
высокой электронной плотности диаметром
20-50 нм с мелкозернистой или пластинчатой
структурой, разбросанные по митохондриальному
матриксу, содержащие ионы Са2+
и Mg2+,
а также другие дивалентные катионы.
Функция гранул выяснена неполностью;
предполагается, что их катионы необходимы
для поддержания активности митохондриальных
ферментов.
Митохондриальная
ДНК (мтхДНК) – образует
собственный
геном митохондрий, на
который приходится около 1% общего
содержания ДНК в клетке и который
включает 37 генов (в ядре клеток человека
насчитывают примерно 100 тыс. генов).
МтхДНК – кольцевой формы двунитчатая
молекула ДНК длиной 5.5 мкм и толщиной 2
нм (в каждой митохондрии имеется 2-10
таких молекул). Она сходна с бактериальной
ДНК и отличается от ядерной ДНК
генетическим кодом, низким содержанием
некодирующих последовательностей и
отсутствием связи с гис-тонами.
Генетическая
информация мтхДНК обеспечивает
синтез лишь 5-6% митохондриальных белков,
в частности, большей части ферментов
электронтранспортной системы и некоторых
ферментов синтеза АТФ. Синтез других
белков и репликация митохондрий
контролируются ядерной ДНК. МтхДНК
кодирует иРНК, тРНК и рРНК, формируя,
таким образом, частично независимую от
ядра систему
репликации, транскрипции и трансляции.
Вместе
с тем, синтез мтхДНК и РНК зависит от
ферментов, которые являются продуктами
ядерных генов. Большая часть рибосомалъных
белков митохондрий синтезируется в
цитоплазме, а затем транспортируется
в митохондрии. Область митохондрии,
содержащая мтхДНК, иногда выявляется
в матриксе как тонкофибриллярная зона
низкой плотности (нуклеоид).
Наследование
мтхДНК у многих
видов, включая человека, происходит
только
от матери (мтхДНК
отца исчезает при образовании эмбриона).
Повреждение
мтхДНК и митохондриальные болезни.
МтхДНК
часто испытывает повреждения,
что
объясняется ее расположением
непосредственно в митохондриальном
матриксе, где она постоянно подвергается
окислительному
стрессу высокой
интенсивности из-за образования в
нем значительного количества биоокислителей
(перекиси водорода и реактивных
радикалов кислорода). Вследствие этого
частота мутаций мтхДНК в 10 раз выше, чем
ядерной, что усугубляется отсутствием
защитных белков, контроля репликации
и неэффективной репарацией. Мутации
мтхДНК вызывают ряд заболеваний (так
называемых “митохондриальных
болезней”) с
широким спектром клинических проявлений
(слепота, глухота, нарушения движения,
сердечная недостаточность, диабет,
патология печени и почек и др.). Симптомы
большинства митохондриальных болезней
проявляются с возрастом, что, вероятно,
обусловлено накоплением мутаций,
связанных с “окислительными ударами”
по мтхДНК. Так как биоокислители
генерируются в максимальных количествах
при окислительном фосфорилировании,
чаще поражаются органы, наиболее
нуждающиеся в энергии, продуцируемой
митохондриями (UHC,
сердце, скелетные мышцы, почки, печень,
островки Лангерганса). Диагноз некоторых
митохондриальных болезней может быть
поставлен при изучении биоптата мышечной
ткани, в котором выявляются аномальные
митохондрии.
Жизненный
цикл митохондрий сравнительно
короткий (около 10 сут); их разрушение
происходит путем аутофагии, а гибнущие
орга-неллы замещаются новыми, которые
формируются путем перешнуровки
предсуществующих. Репликация
мтхДНК происходит в любые фазы клеточного
цикла независимо от репликации ядерной
ДНК.
Окислительное фосфорилирование
– это многоэтапный процесс, происходящий
во внутренней мембране митохондрий и
заключающийся в окислении восстановленных
эквивалентов (НАДН и ФАДН2) ферментами
дыхательной цепи и сопровождающийся
синтезом АТФ.
Согласно гипотезе Питера
Митчела перенос электронов, происходящий
во внутренней митохондриальной мембране,
вызывает выкачивание ионов Н+ из матрикса
митохондрий в межмембранное пространство.
Это создает градиент концентрации ионов
Н+ между цитозолем и замкнутым
внутримитохондриальным пространством.
Ионы водорода в норме способны возвращаться
в матрикс митохондрий только одним
способом – через специальный фермент,
образующий АТФ – АТФ-синтазу.
По современным представлениям
внутренняя митохондриальная мембрана
содержит ряд мультиферментных комплексов,
включающих множество ферментов. Эти
ферменты называют дыхательными
ферментами, а
последовательность их расположения в
мембране – дыхательной
цепью или
электрон-транспортной цепью.
Принцип работы дыхательной
цепи
- Образующиеся в реакциях
катаболизма НАДН и ФАДН2 передают
атомы водорода (т.е. протоны водорода
и электроны) на ферменты дыхательной
цепи. - Электроны движутся по
ферментам дыхательной цепи и теряют
энергию. - Эта энергия используется
на выкачивание протонов Н+ из
матрикса в межмембранное пространство. - В конце дыхательной цепи
электроны попадают на кислород и
восстанавливают его до воды. - Протоны Н+ стремятся
обратно в матрикс и проходят через
АТФ-синтазу. - При этом они теряют энергию,
которая используется для синтеза АТФ.
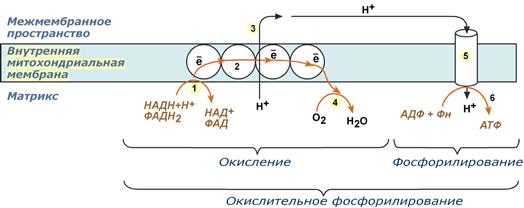
Общая схема окислительного
фосфорилирования
Таким образом, восстановленные формы
НАД и ФАД окисляются ферментами
дыхательной цепи. Благодаря этому
происходит присоединение фосфата к
АДФ, т.е. фосфорилирование. Поэтому
весь процесс целиком получил
название окислительное фосфорилирование.
Коэффициент Р/О –
это отношение количества неорганического
фосфата, включенного в молекулу АТФ
АТФ-синтазой, к количеству атомов
кислорода, включенного в молекулу Н2О,
при переносе одной пары электронов по
дыхательной цепи.
Расчет энергетической
ценности окисления вещества и коэффициента
Р/О
По современным данным
значение коэффициента P/O для
НАДH+H+ соответствует 2,5,
для ФАДH2 – 1,5.
При расчете энергетической
ценности, т.е. количества АТФ, образующейся
при окислении вещества, и коэффициента
Р/О необходимо представлять себе весь
путь этого вещества до полного окисления
его углеродных атомов в СО2. При
этом необходимо учитывать число атомов
углерода в молекуле.
Для расчета Р/О при окислении
какой-либо молекулы необходимо учитывать
следующее:
- для синтеза одной молекулы
АТФ и ее переноса ее в цитозоль требуется 4
протона, - восстановленный эквивалент
(молекула НАДН+H+ или ФАДН2)
передает в цепь переноса электронов
по 2 электрона. - для восстановления кислорода
в воду необходима
1 пара электронов. - при прохождении пары
электронов через всю дыхательную цепь
(от НАДН+H+), т.е. через I, III, IV комплексы
выкачивается 10
ионов Н+,
их энергии достаточно для синтеза 2,5
молей АТФ. - при прохождении пары
электронов от ФАДН2 через
III и IV комплексы дыхательных ферментов
выкачивается 6
ионов Н+, их энергии
достаточно для синтеза 1,5 моля
АТФ.
Митохондрии —
это органеллы размером с бактерию (около
1×2 мкм).
- Во
всех эукариотических клетках. - Митохондрия
ограничена двумя мембранами — гладкой
внешней и складчатой внутренней, имеющей
очень большую поверхность. - Складки
внутренней мембраны глубоко входят в
матрикс митохондрий, образуя поперечные
перегородки — кристы. - Пространство
между внешней и внутренней мембранами
обычно называют межмембранным
пространством.
4. Дыхательная
цепь — ключевой компонент митохондриальной
системы окислительного фосфорилирования.
Структурная организация дыхательной
цепи. Митохондриальная цепь переноса
электронов как часть системы дыхания
всего организма.
Дыхательная
цепь включает множество белков-переносчиков
Всего цепь
переноса электронов (
включает в себя разнообразные белки,
которые организованы в 4 больших
мембраносвязанных мульферментных
комплекса. Также существует еще один
комплекс, участвующий не в переносе
электронов, а синтезирующий АТФ.
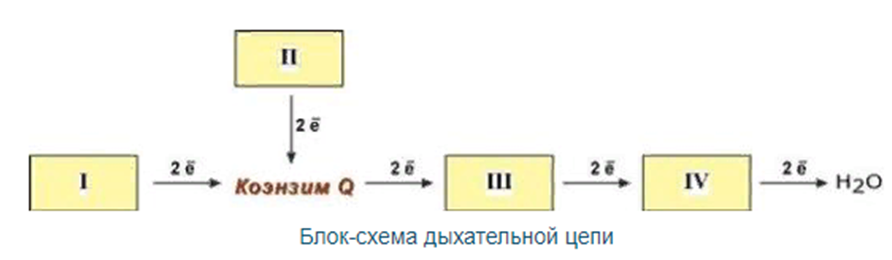
1. Принимает электроны от
НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на
наружную поверхность внутренней
митохондриальной мембраны.
1. Восстановление ФАД в
окислительно-восстановительных реакциях.
2. Обеспечение передачи
электронов от ФАДН2 на железосерные
белки внутренней мембраны митохондрий.
Далее эти электроны попадают на коэнзим
Q (убихинон).
1. Принимает электроны от
коэнзима Q и передает их на цитохром с.
2. Переносит 2 иона Н+ на
наружную поверхность внутренней
митохондриальной мембраны.
1. Принимает электроны от
цитохрома с и передает их на кислород
с образованием воды.
Пятый комплекс – это фермент
АТФ-синтаза, состоящий из множества
белковых цепей, подразделенных на две
большие группы:
• субъединицу Fo – ее функция
каналообразующая, по ней выкачанные
наружу протоны водорода устремляются
в матрикс.
• субъединицу F1 – ее функция
каталитическая, именно она, используя
энергию протонов, синтезирует АТФ.
Механизм работы
АТФ-синтазы получил название вращательный
катализ.
5.
НАД-зависимые и флавиновые дегидрогеназы.
НАДН-дегидрогеназа. Убихинол-дегидрогеназа
(цитохром с-редуктаза). Цитохром
с-оксидаза. Особенности состава, строения,
функций. Коферменты компонентов
дыхательной цепи митохондрий.
Перенос
электронов от окисляемых субстратов к
кислороду происходит в несколько этапов.
В нём участвует большое количество
промежуточных переносчиков, каждый ИЗ
которых способен присоединять электроны
от предыдущего компонента И передавать
следующему. Так возникает цепь
окислительно-восстановительных реакций,
В результате чего происходят восстановление
О2, и синтез Н2О. В дыхательную цепь
митохондрий входит большое число
переносчиков
- ферменты: НАД- или
ФМН(ФАД)-зависимые дегидрогеназы; - цитохромы (гемопротеины,
(комплексы),
связанные между собой убихиноном (КоQ)
и цитохромом с.)
Все
участники этой цепи разделены на четыре
окислительно-восстановительные системы
бы ни был исходный субстрат, электроны
и протоны от флавинов переносятся к
коферменту Q, после которого пути
электронов и протонов расходятся:
электроны далее транспортируются по
цепи цитохромов, а протоны переносятся
из матрикса в межмембранное пространство.
За
исключением убихинона ( КоQ),
все Компоненты ЦПЕ – белки. В составе
этих белков содержатся различные
небелковые компоненты: FМN,
Fе
В составе железо-серных белков и в
составе порфириновых колец, ионы Cu.
- NAD — зависимая
дегидрогеназа катализирует
реакции окисления непосредственно
субстрата (первичная дегидрогеназа).
NAD+ является
коферментом и выполняет роль акцептора
водорода. - FAD — зависимая
дегидрогеназа также
выполняет функцию первичной дегидрогеназы.
Коферментом является FAD, который является
акцептором водорода от субстрата. NADH
— дегидрогеназа катализирует
окисление NADH и восстановление убихинона
(CoQ). Переносчиком водорода является
кофермент — FMN (комплекс 1). В процессе
реакции водород сначала присоединяется
к FMN, соединенному с ферментом, а затем
передается на убихинон. Флавиновые
коферменты (FAD и FMN) прочно связаны с
ферментом как простетические группы,
поэтому ферменты, в состав которых они
входят, называются флавопротеины.
Флавинмононуклеотид (FMN), или рибофлавин
фосфат, неразрывно связан с белковой
частью фермента. Строго говоря, FMN не
является нуклеотидом, так как флавиновая
часть связана с рибитолом, а не с рибозой. - Убихинон (кофермент
Q) — производное изопрена. Кофермент Q
действует как переносчик электронов
на цитохромы. - Цитохромы —
это гемопротеины — белки, содержащие
в качестве прочно связанной простетической
группы гем.
Атом железа в геме может
менять валентность, присоединяя или
отдавая электроны.
В дыхательной цепи цитохромы
служат переносчиками электронов и
располагаются соответственно величине
окислительно—восстановительного
потенциала следующим образом: B, С1,
С, а, а3.
Цитохромоксидаза переносит
электроны с цитохрома С на кислород. В
переносе электронов участвуют сначала
ионы железа цитохромов а и а3,
а затем ион меди цитохрома а3.
Строение ферментативных
комплексов
дыхательной цепи
Соседние файлы в папке все
Энергетический обмен, митохондрии
Каждая клетка –
сложная высокоупорядоченная система
и содержимое клетки находится в состоянии
непрерывного активного метаболизма.
Реакции в клетке
подразделяют на две группы:
1) Реакции синтеза
крупных молекулярных структур, которые
протекают с затратой энергии, называются
реакциями синтеза, ассимиляцией или
анаболизмом.
2) Реакции распада
крупных молекул на более мелкие и
простые, протекающие обычно с высвобождением
энергии. Реакции диссимиляции или
катаболизма.
Реакции ассимиляции
формируют так называемый пластический
тип метаболизма. А реакции диссимиляции
– это реакции энергетического обмена.
Все реакции
пластического и энергетического обмена
можно назвать метаболизмом.
Поступающие в
клетку вещества служат строительным
материалом для биосинтеза клеточных
структур и компонентов клетки, а
во-вторых, эти же вещества являются
источником химической энергии.
У всех эукариотических
клеток можно выделить три типа органоидов
энергетического обмена. В растительных
клетках это тилакоидные мембраны
пластиды,
в животных – внутренние мембраны
митохондрий,
а у аэробных бактерий – сопрягающие
мембраны.
На самом деле, пластиды и митохондрии
имеют сопрягающую мембрану.
Для всех сопрягающих
мембран характерны особенности, которые
отличают эту мембрану от других мембран
эукариотических клеток:
1) Сопрягающие
мембраны способны синтезировать
АТФ за счет
внешних ресурсов.
2) Сопрягающие
мембраны несут цепь
переноса электронов.
3) Сопряженные
мембраны имеют специальные «грибовидные»
тельца, в которых находится фермент,
обеспечивающий синтез молекул АТФ с
названием АТФ-синтетаза.
4) Во всех сопрягающих
мембранах содержится повышенная
концентрация белков и низкая концентрация
холестерина.
Преобладающим
фосфолипидом в этих мембранах является
кардиолипин, наличие которого обуславливает
крайне низкую
избирательную способность.
Основой для
связывания двух биохимических процессов,
протекающих на сопрягающей мембране
является мембранный потенциал, который
создается на сопрягающей мембране.
Митохондрии.
Открыл в 1848 году,
Альтман.
Есть почти у всех
эукариотов. Это подвижные органоиды,
могут менять свою морфологию, объединяться,
разъединяться с помощью микротрубочек.
Различные по форме.
Период жизни
митохондрий короток. У человека они
живут 9 суток. Более 10 суток митохондрии
не живут, т.е., высокая степень обновления.
Основная функция
митохондрий – синтез
АТФ, дающий
энергию для всех жизненных процессов.
Митохондрии встречаются практически
у всех эукариотических клеток, кроме
двух видов паразитических амеб.
Митохондрии являются подвижными
пластичными органоидами, они могут
объединяться в гигантские структуры и
наоборот – разрушаться. Совокупность
всех митохондрий в клетке – хондриом.
Размеры варьируют от 1 до 10 мкм. Форма
чрезвычайно разнообразна. Но несмотря
на разнообразие форм и размеров, для
всех митохондрий характерен единый тип
строения. Митохондрия состоит из двух
мембран, наружной и внутренней, меж
которыми находится межмембранное
пространство, которое по сути является
протонным резервуаром. Внутри –
митохондриальный
матрикс.
Наружная мембрана
характеризуется большим количеством
транспортных белков. Эти белки имеют
специфическое название порины.
Они образуют широкие гидрофильные
каналы в бислое липидов, которые
пропускают молекулы с молекулярной
массой до 10000 Дальтон. На наружной
мембране имеются ферменты, которые
превращают липиды в реакционноспособные
соединения. Белков менее 20%. Из физических
свойств можно отметить, что наружная
мембрана может только необратимо
растягиваться.
Внутренняя мембрана
легко сморщивается и растягивается.
Она образует многочисленные складки,
которые называются кристы. Площадь
внутренней мембраны почти в
пять-семь раз больше,
чем наружной. Кристы бывают двух типов
– пластинчатые
в клетках многоклеточных животных и
растений; трубчатые
в тканях синтезирующих ферменты. Кристы
не статистические образования. Расположены
параллельно или перпендикулярно длинной
оси митохондрий.
Степень развития
крист, их количество определяется
функциональной значимостью клетки. На
внутренней мембране очень низок уровень
холестерина. Много особого фосфолипида
кардиолипида. Благодаря этому мембрана
имеет малую
проницаемость.
При суммарном подсчете и вычислении
соотношения белков и липидов получим,
что белков 75%, а липидов 25%.
- Грибовидные тельца
с АТФ-синтетазой; - Специфические
транспортные белки, регулирующие
перенос метаболитов в матрикс митохондрий
и из матрикса.
Межмембранное
пространство или протонный резервуар.
По химическому составу почти идентичен
цитозолю. Содержится только несколько
ферментов для обеспечения реакции
фосфорилирования.
Матрикс –
высококонцентрированная смесь, более
чем из ста компонентов, большинство из
которых – это ферменты цикла Кребса
(карбоновых кислот). Здесь же располагаются
кольцевые молекулы, митохондриальная
ДНК, тРНК, иРНК и митохондриальные
рибосомы с константой седиментации от
55 до 75S
Белки цепи
переноски электронов.
Это крупные ферментные комплексы, по
которым электроны опускаются на все
более низкие энергетические уровни.
Конечным акцептором является молекулярный
кислород. В цепи выделяют электрон-собирающие
и электрон-распределяющие участки и
последовательные ряды ферментов, с
которыми взаимодействуют электроны,
можно разделить на три главных
ферментативных комплекса:
- НАДН+-дегидрогеназный
комплекс. Состоит из двенадцати
полипептидных цепочек. Главные из этих
компонентов является НАДН+
и убихинон (ко Q). НАДН+-дегидрогеназа
первая принимает 2 протона и 2 электрона.
Убихинон –
небольшой переходный переносчик,
который тоже принимает и протоны и
электроны. Переносит протоны через
мембрану на наружную поверхность
сопрягающей мембраны. - Комплексу B=С
Этот комплекс состоит из 8 полипептидных
цепей. Содержит два цитохрома (В и С),
которые передают только электроны, а
протоны сбрасываются в межмембранное
пространство.
При этом, цитохром
С, принимающий электроны, передает их
на 3 комплекс.
Особую роль играют
Fe содержащие полипептиды. Они различаются
между собой в степени сродства к
электронам, которое выражается через
окислительно-восстановительный потенциал
молекулы. Чем выше этот потенциал, тем
больше сродство окисленной молекулы к
электрону. Электроны переходят по цепи
переноса. Их коферменты восстанавливаются
и окисляются. Цитохромидаза передает
электрон с комплекса цитохрома на
молекулярный кислород. Кислород
активируется и связывается с электронами.
Это важная реакция, в ней кислород
приобретает отрицательный заряд,
благодаря чему водород соединяется с
ним, и образуются вода.
Электроны
перемещаются в толще внутренней мембраны,
при этом через внутреннюю мембрану они
не проходят и остаются на внутренней
стороне мембраны. Протоны обратно не
возвращаются. Они остаются на внешнем
мембранном пространстве. На каждую
исходную молекулы C6H12O6
64 протона. В результате работы дыхательной
цепи на мембранах создается разных
электрических потенциалов. Внутренняя
сторона мембраны заряжается отрицательно
за счет скопления на ней электронов, а
наружная сторона внутренней мембраны
заряжается положительно.
Кроме того, поток
протонов создает между двумя сторонами
внутренней мембраны разность значения
рН. Таким образом, мы имеем кроме
мембранного потенциала еще и градиент
рН. Вместе они составляют электрохимический
протонный градиент. Величина
электрохимического протонного градиента,
который стимулирует синтез, равно 200
мВ. Заствляет ионы двигаться внутрь
матрикса. Заряд – источник протон-движущей
силы.
Грибовидное тело.
Белковый комплекс, который состоит из
двух основных частей: ножки (протон-движущий
канал) и головки (сопрягающего фактора).
Ножка находятся в толще внутренней
мембраны, имеет гидрофобную природу и
по сути является протон-проводящим
канал, по которому протоны из межмембранного
пространства возвращаются в матрикс
митохондрий
Головка тела
называется сопрягающий фактор. Здесь
располагается фермент АТФ-синтетаза,
который превращает энергию движения
протона в энергию органического синтеза,
синтезируя АТФ из молекулы АДФ и
неорганического фосфата (реакция
фосфорилирования).
АТФ занимает 15%
всех белков и образуется при прохождении
1-2 протонов.
Субстратами для
дыхания служат неорганические соединения.
Большинство клеток используют углеводы.
Вовлекаются в процесс расщепления
только после гидролиза до моносахаридов.
Крахмал гидрализуется в глюкозу. Гликоген
гидролизуется примерно до 30000 остатков
глюкоз. Ферментативное расщепление
этих запасных углеводов составляет
первый подготовительный этап
энергетического обмена. Вторым этапом
энергетического обмена является неполное
окисление глюкозы. Оно всегда
бескислородное. Всегда происходит
непосредственно в цитоплазме клетки и
называется гликолизом.
Гликолиз – неполное бескислородное
расщепление глюкозы или многоступенчатый
процесс по превращению углерода в 2
молекулы пировиноградной кислоты
(С3Н4О3).
В ходе гликолиза
выделяется большое количество энергии
(200 кДж на моль), 60% этой энергии рассеивается
в виде тепла, а 40% используется на синтез
АТФ. Кроме двух молекул пирувата,
образуются протоны, которые в цитоплазме
клетки запасаются в форме переносчика.
У животных преобладающим переносчиком
является НАДФ и соединяется с протоном.
Дальнейшая судьба
пирувата имеет три пути:
1) Характерный для
дрожжей и клеток растений при недостатке
кислорода происходит спиртовое брожение
и ПВК восстанавливается до этилового
спирта (С2Н5ОН).
2) В клетках животных
при недостатке кислорода. Накопление
в мышечных волокнах молочной кислоты.
Пируват восстанавливается до молочной
кислоты (С3Н6О3).
3) При наличии в
среде кислорода, продукты гликолиза
расщепляются до СО2
и Н2О
(полное окисление или клеточное дыхание).
Продукты гликолиза переходят для
дальнейшего расщепления в матрикс
митохондрий, где протекает третий этап
энергетического обмена – клеточное
дыхание. Пируват, одновременно с потоком
протонов, направляется внутрь митохондрий.
В матриксе молекулы пирувата взаимодействуют
с каталитическими белками и преобразуется
в молекулу ацетил-коА.
Только он
может вступить в цикл Кребса. Он
вовлекается в цикл трикарбоновых кислот,
который представляет собой цепь
последовательных реакций, в ходе которых
из одной молекулы ацетил-коА образуются
молекулы углекислого газа, 2 АТФ и 4 атома
водорода. Таким образом, в результате
бескислородного окисления и цикла
Кребса, одна молекула глюкозы расщепляется
до диоксида углерода, который легко
выходит из клетки через мембрану и
высвобождающееся при реакции энергия
расходуется в небольшом количестве на
синтез АТФ, а в основном запасается в
нагруженных электронами переносчиков.
Белки-переносчики транспортируют
протоны и электроны к внутренней мембране
митохондрий, где передают их на цепь
дыхательных ферментов.
Транспорт протонов
и электронов приводит к накоплению в
протонном резервуаре протонов. Наружная
поверхность внутренней мембраны заряжена
положительно. Электроны обеспечивают
отрицательный заряд внутренней стороны
мембраны. Когда разность потенциалов
= 200мВ, открывается канал в ножке
грибовидного тела, протоны проталкиваются
через ножку, отдавая энергию ферменты
АТФ-синтетазе, что обеспечивает реакцию
фосфорилирования.
Синтез АТФ сопряжен
с обратным потоком протонов в матрикс.
Протонный градиент
через внутреннюю мембрану митохондрий
дает примерно 24 кДЖ на моль переносимых
протонов. И процесс переноса электронов
(окисление) в мембранах связан с
образованием АТФ из АДФ (реакция
фосфорилирования) и поэтому весь
называется окислительное фосфорилирования.
Ведущую роль в
этих реакциях выполняет внутренняя
сопрягающая мембрана митохондрий. В
процессе окислительного фосфорилирования
перенос каждой пары электронов с
переносчика на молекулярный кислород
доставляет энергию примерно для
образования трех молекул АТФ. При
окислении одной молекулы глюкозы
образуется в реакциях третьего этапа
36 молекул АТФ. Две молекулы АТФ образуются
в бескислородном втором этапе обмена
и поэтому общий выход = 38 молекул АТФ на
одну полностью окисленную молекулу
глюкозы. 55% энергии запасается в виде
химических связей, 45% энергии рассеивается
в виде теплоты.
Сопряжение окисления
и фосфорилирование известно как
хемиосмотическая гипотеза Митчела.
В1978 году он был лауреатом нобелевской
премии за исследование процесса переноса
энергии в клетках и разработку
хемиосмотической теории. Эта теория
объясняет механизм преобразования
энергии в биологической мембране при
синтезе АТФ.
Обмен веществ
между цитоплазмой и матриксом
обеспечивается специальными транспортными
системами, локализованными во внутренней
мембране митохондрии и обеспечивающие
перенос веществ разными механизмами
активного транспорта.
1) По механизма
типа антипорт, когда два вещества
переносятся одновременно в противоположных
направлениях. Большая часть АТФ,
продуцированная митохондриями, выходит
в цитоплазму. Этот перенос осуществляется
АТФ-АДФтранслоказой
2) Симпорт или
сопряженный транспорт. Таким образом,
при участии специфического переносчика
осуществляется одновременный перенос
пирувата и ионов фосфата и протонов.
3) Унипорт. Облегченная
диффузия. Только одно вещество переносится
через мембрану в одном направлении
(ионы кальция внутрь матрикса). С помощью
транспортных белков.
Митохондрия –
полуавтономный органоид. Митохондрии
увеличиваются в количестве при делении
клеток (особенно в период G2),
при увеличении функциональной активности
и нагрузки клетки. Увеличение их
количества происходит путем роста и
деления материнских митохондрий. Делятся
митохондрии путем перетяжки, или
отпочковывания, или возникновения
дочерних митохондрий внутри материнских.
В матриксе
митохондрий содержится собственная
генетическая система, необходимая для
процессов воспроизведения. Это
митохондриальная ДНК, митохондриальные
рибосомы. Гистонов нет. Эти структуры
были обнаружены в 1963 году Нассом.
Митохондриальная ДНК имеет кольцевую
природу. Известно, что все митохондрии
содержат несколько копий своего генома.
От одной копии до десяти. Линейная длина
молекулы варьирует от 5 до 30 мкм. Из
нуклеотидных оснований преимущественно
гуанин и цитозин.
Рибосомы вариабельны,
с константой седиментации 55 – 75S. В 1981
году была расшифрована нуклеотидная
последовательность митохондриального
генома человека. Было показано, что в
митохондриях человека содержится 2 гена
рРНК, 22 гена тРНК и 13 генов, которые
кодируют белки. Репликация и транскрипция
происходят в матриксе митохондрий, и в
этих процессах преобладает контроль
со стороны ядерного генома. Делению или
репродукции митохондрий обязательно
предшествует репликация митохондриальной
ДНК. И этот процесс происходит независимо
от репликации ядерной ДНК. Но обычно
тогда, когда уже ядерная ДНК вся
реплицировалась.
Происхождение и
эволюцию митохондрий объясняют с позиции
эндосимбиотической
гипотезы. И
эта же самая гипотеза представляет
современные митохондрии прямыми
потомками бактериального симбионта.
Это особая группа фотосинтезирующих
бактерий, которые утратили, внедрившись
в организм хозяина, способность к
фотосинтезу, но сохранили дыхательную
функцию. Эти пурпурные бактерии,
внедрившись в другую эукариотическую
клетку, укоренились к ней.
Последние наблюдения
цитологов после расшифровки генома
показали, что митохондрии эволюционировали
вместе со всеми эукариотами от одного
общего предка (коэволюция – совместная
эволюция). Эволюционно, митохондриальный
и ядерные
компоненты
эукариот возникли одновременно.
С хема главной (полной) дыхательной цепи митохондриального окисления Этапы дыхательной цепи
1. Дегидрирование
субстрата (отнятие
от него 2 протонов и 2 электронов)
первичными дегидрогеназами. Чаще всего
их роль выполняют никотинамидные
ферменты.
Небелковая часть
этих ферментов представляет собой
динуклеотид: НИКОТИНАМИД-АДЕНИНДИНУКЛЕОТИД
(НАД+)
или НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ
(НАДФ+).
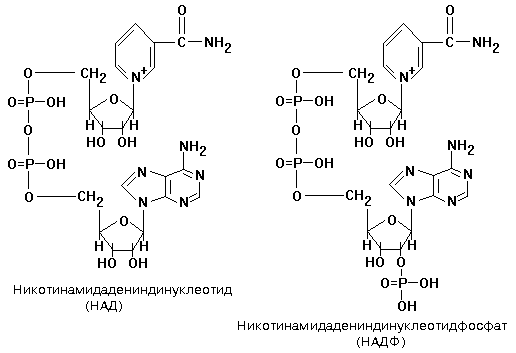
НАД+
и НАДФ+
входят в
состав каталитического центра
никотинамидных дегидрогеназ. Они
являются КОФЕРМЕНТАМИ, и присоединяются
к белковой части только в момент реакции
окисления субстрата, протекающего
обычно по механизму:
Из матрикса
митохондриальный НАДН2
отдает два атома водорода на «комплекс
I»,
встроенный во внутреннюю мембрану
митохондрий.
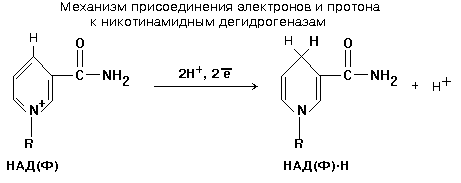
.
Передача протонов и электронов на
флавиновые ферменты, выполняющие роль
вторичных дегидрогеназ (комплекс1).
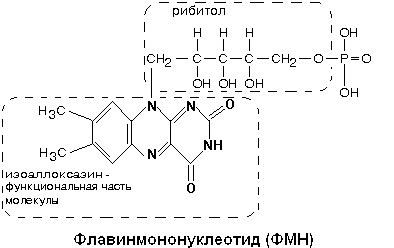
Из небелковых
компонентов КОМПЛЕКС I
содержит флавинмононуклеотид (ФМН) и
пять железо-серных центров FeS.
В транспорте
водорода по дыхательной цепи в этом
комплексе принимает участие ФМН.
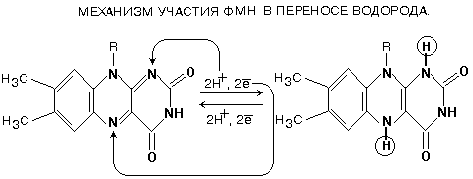
Одновременно с
протонами транспортируются и электроны.
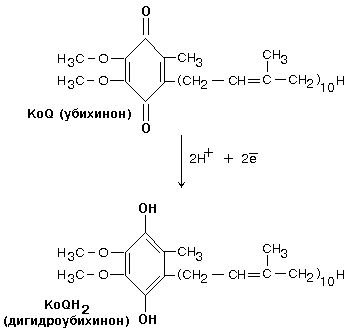
спользуя
энергию, выделяющуюся при переносе
электронов по дыхательной цепи, Комплекс
I
транспортирует 4 протона из матрикса в
межмембранное пространство – работает
как протонный генератор. Точный механизм
этого транспорта до сих пор неизвестен.
3. Передача протонов
и электронов от флавиновых ферментов
на кофермент Q.
Кофермент Q
– это
жирорастворимое низкомолекулярное
вещество, содержащее длинную изопреновую
цепь, не имеет белковой части. КоQ
принимает водород от комплекса I.
Образовавшийся КоQH2
отдает водород на комплекс III.
4.
Передача электронов от КоQ
на О по системе цитохромов.
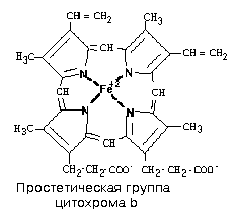
В своем составе
комплекс III
содержит: цитохромы – сложные белки,
содержащие небелковый компонент –
простетическую группу, сходную по
строению с небелковой частью гемоглобина
– гемом и FeSIII
– железо-серный
кластер.
Цитохромы расположены
в дыхательной цепи в следующей
последовательности:
цит С1 цит
А цит аа3
цит В
Цитохромы А, В, С
различаются строением гемма. Цитохромы
С и С1,
а и а3
различаются белковой частью.
т
двух атомов водорода, которые переносятся
на комплекс III
от KoQ,
дальше по цепи транспортируются только
электроны, два протона (H+)
комплекс III
выбрасывает в межмембранное пространство
вместе с еще одной парой протонов,
которые подхватываются комплексом из
матрикса. Таким образом, комплекс III
в сумме выбрасывает в межмембранное
пространство 4 протона.
протонным генератором,
Комплекс IV
называется цитохромоксидазой. Это
единственный цитохром, обладающий
каталитическими, т. е. ферментативными,
свойствами, другие цитохромы не являются
ферментами. Он
способен захватывать из матрикса 4
протона. Два из них он отправляет в
межмембранное пространство, а остальные
передает на образование воды.
СОКРАЩЕННАЯ
(УКОРОЧЕННАЯ) ДЫХАТЕЛЬНАЯ ЦЕПЬ
Принимают участие
два субстрата.
Сукцинат
(янтарная кислота),
который окисляется ферментом
сукцинатдегидрогеназой
и ацил-Ко А
– ацил-Ко
А-дегидрогеназа.
Эти субстраты
передают атомы водорода на комплекс
II,
который в укороченном варианте цепи
является начальным звеном окисления.
В составе комплекса – простетическая
группа ФАД и FeSII
железо-серный
кластер.
От ФАД.Н2
два атома водорода переносятся на KoQ.
Значит, первое звено, которое имеется
в полной цепи – исключается. Перепад
окислительно-восстановительного
потенциала между ФАД и KoQ
невелик. Поэтому переноса H+
в межмембранное пространство в этой
точке не происходит.
Затем окисление
проходит аналогично главной дыхательной
цепи.
МАКСИМАЛЬНО
СОКРАЩЕННАЯ (МАКСИМАЛЬНО УКОРОЧЕННАЯ)
ДЫХАТЕЛЬНАЯ ЦЕПЬ.
Она представлена
только цитохромной частью. Здесь может
быть окислен только один субстрат –
аскорбиновая кислота. С участием
фермента, восстановленные эквиваленты
витамина С включаются в цепь на уровне
цитохрома С.
Митохондрии
– это структуры палочковидной или
овальной формы (греч. mitos
–
нить,
chondros
– гранула). Они обнаружены во всех животных
клетках (исключая зрелые эритроциты):
у высших растений, у водорослей и
простейших. Отсутствуют они только у
прокариот бактерий.
Эти
органеллы впервые были обнаружены и
описаны в конце прошлого столетия
Альтманом. Несколько позже эти структуры
были названы митохондриями. В 1948 г.
Хогебум указал на значение митохондрий
как центра клеточного дыхания, а в 1949
г. Кеннеди и Ленинджер установили, что
в митохондриях протекает цикл
окислительного фосфорилирования. Так
было доказано, что митохондрии служат
местом генерирования энергии.
Митохондрии видны
в обычном световом микроскопе при
специальных методах окраски. В фазово
– контрастном микроскопе и в «темном
поле» их можно наблюдать в живых клетках.
Строение,
размеры, форма
митохондрий очень вариабельны. Это
зависит в первую очередь от функционального
состояния клеток. Например, установлено,
что в мотонейронах мух, летающих
непрерывно 2 часа, проявляется огромное
количество шаровидных митохондрий, а
у мух со склеенными крыльями число
митохондрий значительно меньше и они
имеют палочковидную форму (Л. Б. Левинсон).
По форме они могут быть нитевидными,
палочковидными, округлыми и гантелеобразными
даже в пределах одной клетки.
Митохондрии
локализованы в клетке, как правило, либо
в тех участках, где расходуется энергия,
либо около скоплений субстрата (например,
липидных капель), если таковые имеются.
Строгая ориентация
митохондрий обнаруживается вдоль
жгутиков сперматозоидов, в поперечно-полосатой
мышечной ткани, где они располагаются
вдоль миофибрилл, в эпителии почечных
канальцев локализуются во впячиваниях
базальной мембраны и т.д.
Количество
митохондрий в клетках имеет органные
особенности, например, в клетках печени
крыс содержится от 100 до 2500 митохондрий,
а в клетках собирательных канальцев
почки – 300, в сперматозоидах различных
видов животных от 20 до 72, у гигантской
амебы Chaos
chaos
их число достигает
500 000. Размеры митохондрий колеблются
от 1 до 10 мкм.
Ультрамикроскопическое
строение митохондрий однотипно,
независимо
от их формы и размера. Они покрыты двумя
липопротеидными мембранами: наружной
и внутренней. Между ними располагается
межмембранное пространство.
Впячивания
внутренней мембраны, которые вдаются
в тело митохондрий, называются кристами.
Расположение крист в митохондриях может
быть поперечным и продольным. По форме
кристы могут быть простыми и разветвленными.
Иногда они образует сложную сеть. В
некоторых клетках, например, в клетках
клубочковой зоны надпочечника кристы
имеют вид трубочек. Количество крист
прямо пропорционально интенсивности
окислительных процессов, протекающих
в митохондриях. Например, в митохондриях
кардиомиоцитов их в несколько раз
больше, чем в митохондриях гепацитов.
Пространство, ограниченное внутренней
мембраной, составляет внутреннюю камеру
митохондрий. В нем между кристами
находится митохондриальный матрикс —
относительно электронно плотное
вещество.
Белки внутренней
мембраны синтезируются миторибосомами,
а белки внешней мембраны – циторибосомами.
‘Наружная мембрана
митохондрий по многим показателям
сходна с мембранами ЭПС. Она бедна
окислительными ферментами. Немного их
и в мембранном пространстве. Зато
внутренняя мембрана и митохондриальный
матрикс буквально насыщены ими. Так, в
матриксе митохондрий сосредоточены
ферменты цикла Кребса и окисления жирных
кислот. Во внутренней мембране локализована
цепь переноса электронов, ферменты
фосфорилирования (образования АТФ из
АДФ), многочисленные транспортные
системы.
Кроме белка и
липидов, в состав мембран митохондрий
входит РНК, ДНК, последняя обладает
генетической специфичностью, и по своим
физико-химическим свойствам отличается
от ядерной ДНК.
При
электронно-микроскопических исследованиях
обнаружено, что поверхность наружной
мембраны покрыта мелкими шаровидными
элементарными частицами. Внутренняя
мембрана и кристы содержат подобные
элементарные частицы на «ножках», так
называемые грибовидные тельца. Они
-состоят из трех частей: головки
сферической формы (диаметр 90-100 А°), ножки
цилиндрической формы, длиной 5 нм и
шириной 3-4 нм, основания, имеющего размеры
4 на 11 нм. Головки грибовидных телец
связаны с фосфорилированием, затем
обнаружено, что головки содержат фермент,
обладающий АТФ-идной активностью.
В межмембранном
пространстве находится вещество,
обладающее более низкой электронной
плотностью, чем матрикс. Оно обеспечивает
сообщение между мембранами и поставляет
для ферментов, находящихся в обеих
мембранах, вспомогательные
катализаторы-коферменты.
В
настоящее время известно, что наружная
мембрана митохондрий хорошо проницаема
для веществ, имеющих низкий молекулярный
вес, в частности, белковых соединений.
Внутренняя мембрана митохондрий обладает
избирательной проницаемостью. Она
практически непроницаема для анионов
(Cl-1,
Br-1,
SO4-2,
HCO3-1,
катионов Sn+2,
Mg+2,
ряда cахаров
и большинства аминокислот, тогда как
Са2+,
Мп2+,
фосфат, многокарбоновые
кислоты
легко проникают через нее. Имеются
данные о наличии во внутренней мембране
нескольких переносчиков, специфических
к отдельным группам проникающих анионов
и катионов. Активный транспорт веществ
через мембраны осуществляется благодаря
использованию энергии АТФ-азной системы
или электрического потенциала,
генерируемого на мембране в результате
работы дыхательной цепи. Даже АТФ,
синтезированная в митохондриях, может
выйти с помощью переносчика (сопряженный
транспорт).
Матрикс
митохондрий представлен мелкозернистым
электронно-плотным веществом. В нем
располагаются миторибосомы, фибриллярные
структуры, состоящие из молекул ДНК и
гранул, имеющих диаметр более 200А◦
образованные
солями: Ca3(PO4),
Ba3(PO4)2,
Mg3(PO4).
Полагают, что гранулы служат резервуаром
ионов Са+2
и Мg+2.
Их количество увеличивается при изменении
проницаемости митохондриальных мембран.
Присутствие
в митохондриях ДНК обеспечивает участие
митохондрий в синтезе РНК и
специфических
белков, а также указывает на существование
цитоплазматической наследственности.
Каждая митохондрия содержит в зависимости
от размера одну или несколько молекул
ДНК (от 2 до 10). Молекулярный вес
митохондриальной ДНК около (30-40)*106
у простейших, дрожжей, грибов. У высших
животных около (9–10) *106.
Длина
ее у дрожжей примерно равна 5 мкм, у
растений – 30 мкм. Объем генетической
информации, заключенный в митохондриальной
ДНК, невелик: он состоит из 15-75 тыс. пар
оснований, которые могут кодировать в
среднем 25-125 белковых цепей с молекулярным
весом около 40000.
Митохондриальная
ДНК
отличается
от ядерной ДНК
рядом особенностей:
более высокой скоростью синтеза (в 5-7
раз), она более устойчива к действию
ДНК-азы, представляет собой двухкольцевую
молекулу, содержит больше гуанина и
цитозина, денатурируется при более
высокой температуре и легче
восстанавливается. Однако не все
митохондриальные белки синтезируются
митохондриальной
системой. Так, синтез цитохрома С и
других
ферментов
обеспечивается информацией, содержащейся
в ядре. В матриксе митохондрий локализованы,
витамины А, В2,
В12,
К, Е,
а
также гликоген.
Функция
митохондрий
заключается
в образовании энергии, необходимой для
жизнедеятельности клеток. Источником
энергии в клетке могут служить различные
соединения: белки, жиры, углеводы. Однако
единственным субстратом, который
немедленно включается в энергетические
процессы, является глюкоза.
Биологические
процессы, в результате которых в
митохондриях образуется энергия, можно
подразделить на 3 группы: I
группа – окислительные реакции, включающие
две фазы: анаэробную (гликолиз) и аэробную.
II
группа – дефосфорилирование, расщепление
АТФ и высвобождение энергии. III
группа – фосфорилирование, сопряженное
с процессом окисления.
Процесс окисления
глюкозы вначале происходит без участия
кислорода (анаэробным или гликолитическим
путем) до пировиноградной или молочной
кислоты.
Однако при этом
энергии выделяется лишь небольшое
количество. В дальнейшем эти кислоты
вовлекаются в процессы окисления,
которые протекают с участием кислорода,
т. е. являются аэробными. В результате
процесса окисления пировиноградной и
молочной кислоты, названной циклом
Кребса, образуется углекислый газ, вода
и большое количество энергии.
Образующаяся
энергия не выделяется в виде тепла, что
привело бы к перегреванию клеток и
гибели всего организма, а аккумулируется
в удобной для хранения и транспорта
форме в виде аденозинтрифосфорной
кислоты (АТФ). Синтез АТФ происходит из
АДФ и фосфорной кислоты и вследствие
этого называется фосфорилированием.
В здоровых клетках
фосфорилирование сопряжено с окислением.
При заболеваниях сопряженность может
разобщаться, поэтому субстрат окисляется,
а фосфорилирование не происходит, и
окисление переходит в тепло, а содержание
АТФ в клетках снижается. В результате
повышается температура и падает
функциональная активность клеток.
Итак,
основная функция митохондрий
заключается
в выработке практически
всей энергии клетки и происходит синтез
компонентов, необходимых для деятельности
самого органоида, ферментов «дыхательного
ансамбля», фосфолипидов и белков.
Еще одной стороной
деятельности митохондрий является их
участие в специфических синтезах,
например, в синтезе стероидных гормонов
и отдельных липидов. В ооцитах разных
животных образуются скопления желтка
в митохондриях, при этом они утрачивают
свою основную систему. Отработавшие
митохондрии могут накапливать также
продукты экскреции.
В
некоторых
случаях (печень, почки) митохондрии
способны аккумулировать вредные вещества
и яды, попадающие в клетку, изолируя их
от основной цитоплазмы и частично
блокируя вредное действие этих веществ.
Таким образом, митохондрии способны
брать на себя функции других органоидов
клетки, когда это требуется для
полноценного обеспечения того или иного
процесса в норме или в экстремальных
условиях.
Биогенез
митохондрий.
Митохондрии
представляют собой обновляющиеся
структуры с довольно кратким жизненным
циклом (в клетках печени крысы, например,
период полужизни митохондрий охватывает
около 10 дней). Митохондрии образуются
в результате роста и деления предшествующих
митохондрий. Деление их может происходить
тремя способами: перетяжкой, отпочковыванием
небольших участков и возникновением
дочерних митохондрий внутри материнской.
Делению (репродукции) митохондрий
предшествует репродукция собственной
генетической системы – митохондриальной
ДНК.
Итак,
согласно взглядам большинства
исследователей, образование митохондрий
происходит преимущественно путем
саморепродукции их de
novo.
Митохондриальное окисление
Система
митохондриального окисления –
мультиферментная система, постепенно
транспортирующая протоны и электроны
на кислород с образованием молекулы
воды. Все ферменты митохондриального
окисления (кроме, никотинамидной
дегидрогеназы) встроены во внутреннюю
мембрану митохондрий. Полный комплекс
таких ферментов образует «дыхательную
цепь», в
пределах которой атомы водорода
отнимаются от субстрата, затем передаются
последовательно от одного переносчика
к другому, и, наконец, на кислород воздуха
с образованием воды.
Существует строгая
последовательность работы каждого
звена в цепочке переносчиков. Эта
последовательность определяется
величиной ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО
ПОТЕНЦИАЛА, сокращенно – ОВП
каждого звена. ОВП – это химическая
характеристика способности вещества
принимать и удерживать электроны. Самый
низкий ОВП имеет начальное звено цепи,
самый высокий – у кислорода, расположенного
в конце цепочки переносчиков. Таким
образом, передача водорода идет от
более низкого к более высокому ОВП.
В настоящее время
различают три варианта дыхательных
цепей:
Главная дыхательная
цепь – это три мультиферментных комплекса,
встроенных во внутреннюю мембрану
митохондрии. Обозначаются они латинскими
цифрами – I,
III
и IV.
Субстратами главной
дыхательной цепи являются:
- изолимонная
кислота (изоцитрат) фермент –
изоцитратдегидрогеназа, - яблочная кислота
(малат), фермент – малатдегидрогеназа, - глутаминовая
кислота (глутамат), фермент –
глутаматдегидрогеназа, - β-гидроксиацил-КоА,
фермент – β-гидроксиацил-КоА-дегидрогеназа.